- 029-86354885
- 18392009562

内容提要
近年来,社会压力的增加和其他因素导致抑郁症患者人数的激增。目前,普遍认为严重抑郁症的内因是脑组织去甲肾上腺素(NE)水平降低。去甲肾上腺素与另外两种儿茶酚胺神经递质——肾上腺素(EP)和多巴胺(DA)在结构和化学性质上非常相似。这三种神经递质在生物系统中通过酶反应依次合成。因此,设计去甲肾上腺素特异性荧光探针具有一定的挑战性。作者采用了“保护-去保护”策略:长发射波长含水溶性磺酸的花菁被硫代碳酯保护,去甲肾上腺素β-羟基乙基胺通过亲核取代和分子内亲核环化反应释放荧光团。该策略实现了去甲肾上腺素的特异性红色荧光检测,以及钾离子刺激下去甲肾上腺素神经信号转导的成像。更重要的是,作者首次实现抗抑郁药物刺激大鼠大脑去甲肾上腺素水平的实时荧光成像。
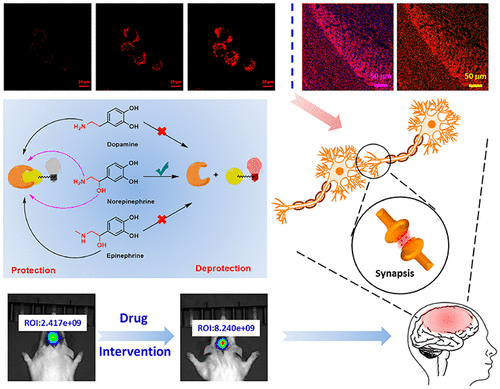
前言
随着社会压力的增加,抑郁症状的患者数量猛增。抑郁症已成为全球残疾的主要原因和全球疾病负担的主要贡献者。抑郁症与大脑中去甲肾上腺素(NE)水平的降低密切相关。去甲肾上腺素是单胺类儿茶酚胺神经递质合成的中心物质,在苯乙醇胺N-甲基转移酶(PMNT)的作用下,多巴胺(DA)的酶促反应,再产生肾上腺素(EP)。这三种单胺类神经递质的结构和性质相似,都是通过酶反应先后合成的。设计能对去甲肾上腺素产生特异性反应的荧光探针是一项极其困难的任务。传统的神经递质检测方法主要依靠电化学分析和质谱分析,但在体内原位检测时往往存在一定的局限性。目前,荧光法检测和标记去甲肾上腺素主要包括以下几个方面。Kleinfeld团队报告了基于细胞的神经递质荧光报告器;CNiFERs用于神经信号传导过程中NE或DA细胞外浓度的变化的荧光成像;Sames报告了使用神经递质荧光染料FFN270对神经信号传导过程中NE的释放进行成像;Li报道NE和GPCR的特异性结合被用来调节与GPCR连接的cpEGFP脱质子过程,释放增强的单通道荧光信号,实现特异性、高灵敏度以及实时监测;Glass小组利用有机小分子对神经递质进行荧光检测。基于去甲肾上腺素特异性反应的荧光探针检测神经递质含量和释放标记物仍然是一个挑战。作者利用花菁作为荧光团,延长去甲肾上腺素的发射波长,引入磺酸盐,大大提高其水溶性,实现了水溶液中去甲肾上腺素的红色荧光检测,并成功标记细胞中的去甲肾上腺素囊泡,对高钾离子刺激下去甲肾上腺素胞排过程进行了成像,实现抗抑郁药氟西汀诱导体内去甲肾上腺素升高的原位成像,对抑郁症药物治疗的研究和筛选具有一定的现实意义。
结果与讨论
作者在体外研究了探针对去甲肾上腺素的紫外-可见和荧光响应。将5 mM NE加入含10 μM探针的2 mL PB (pH 5.0)中。如图1a所示,体系在675和775 nm处的紫外吸收随时间逐渐减小,而在550 nm处的紫外吸收则逐渐增加。因此,在加入NE后,体系的荧光强度在640 nm处逐渐增加,是只含探针的体系的14倍(图1b)。反应后体系的光谱性质与花菁酮本身的光谱性质基本一致。与去甲肾上腺素相比,多巴胺和肾上腺素仍能诱导较少的荧光强度增强(图1c)。作者还研究了其他神经递质(5 mM),如5- HT,GABA和氨基酸(500 μM),如苏氨酸,丝氨酸,赖氨酸,都没有引起探针明显的荧光变化。另外,100 μM半胱氨酸/10 μM同型半胱氨酸与类似的巯基乙胺和5 mM GSH,也没有诱导显著的荧光响应。本工作大大缩短了探针响应时间,在50 min内完成反应,最大限度地减少了氧化还原对去甲肾上腺素的损失。通过质谱证实了探针对去甲肾上腺素的特异性响应机制。
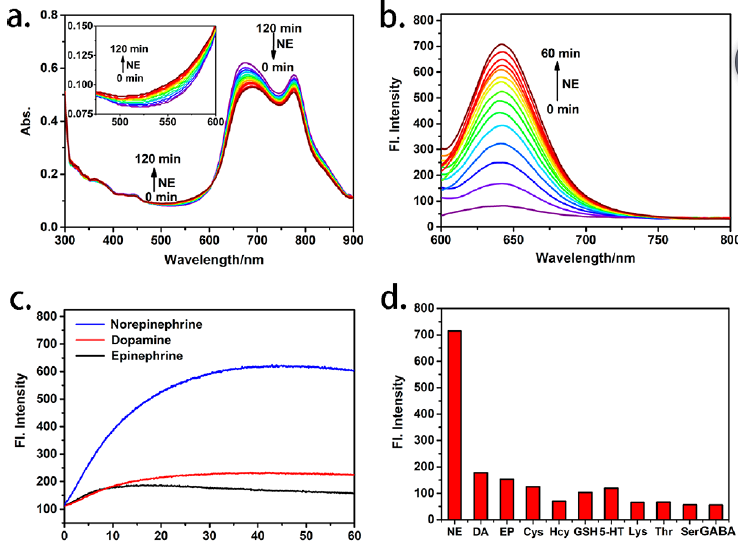
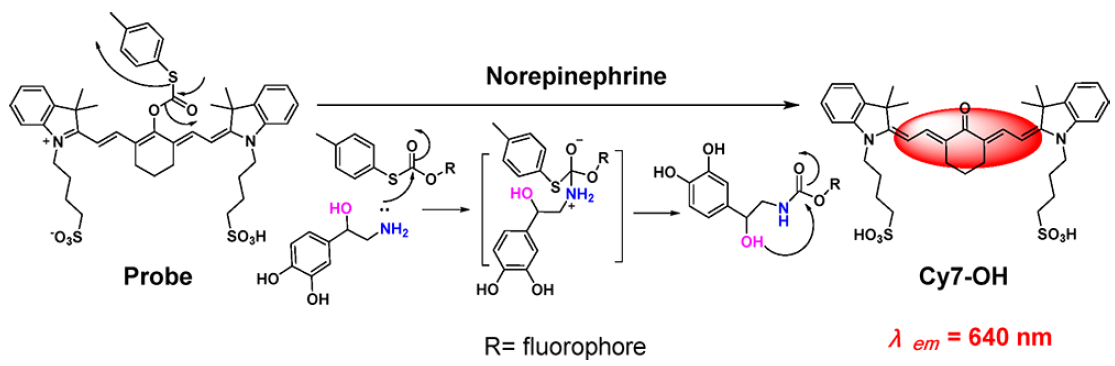
图1. (a) 10 μM探针对5 mM NE在PB (pH 5.0)中的紫外-可见响应0 ~ 120分钟。(b) 10 μM探针对5 mM NE在PB (pH 5.0)中的荧光响应0 ~ 60分钟(λex= 550 nm)。(c)时间依赖10 μM探针5 mM NE、DA,和EP 0−60分钟。(d) 10 μM探针在5 mM的选择性神经递质 (DA,EP,,NE,5-GABA)、谷胱甘肽,氨基酸500 μM(赖氨酸,苏氨酸,丝氨酸), 100 μM Cys和10 μM Hcy。去甲肾上腺素响应机理示意图
作者选择了几种细胞来标记内源性去甲肾上腺素。当20 μM探针与HeLa细胞和HepG-2细胞在37°C下培养40 min时,未观察到明显的荧光发射。PC12细胞可分泌富含去甲肾上腺素的囊泡并有胞吐作用。与PC12细胞在类似条件下培养后,可以观察到明显的红色荧光发射,并随时间的推移而增加(图2)。该探针可以标记囊泡中的去甲肾上腺素去甲肾上腺素排出过程的显像。

图2. PC12细胞、HeLa细胞和HepG2细胞经20μM探针在红色通道中培养5 ~ 40分钟(λex = 561 nm, bar = 20μM)。
高浓度钾刺激细胞产生的动作电位导致电压依赖性钙离子通道去极化,打开钙离子通道。在电化学电位的驱动下,钙离子从外部流入细胞,细胞质中钙离子浓度的增加触发了囊泡与细胞质膜的融合,可以刺激神经递质的释放。作者用高K+溶液刺激孵育探针标记的去甲肾上腺素囊泡的PC12细胞,细胞内的荧光点强度逐渐降低。但在相同条件下,用PBS(不含钾离子)刺激细胞,红色通道的荧光强度几乎没有变化(图3)表明,K+浓度增加导致细胞胞饮,探针实现了去甲肾上腺素信号通路的可视化。
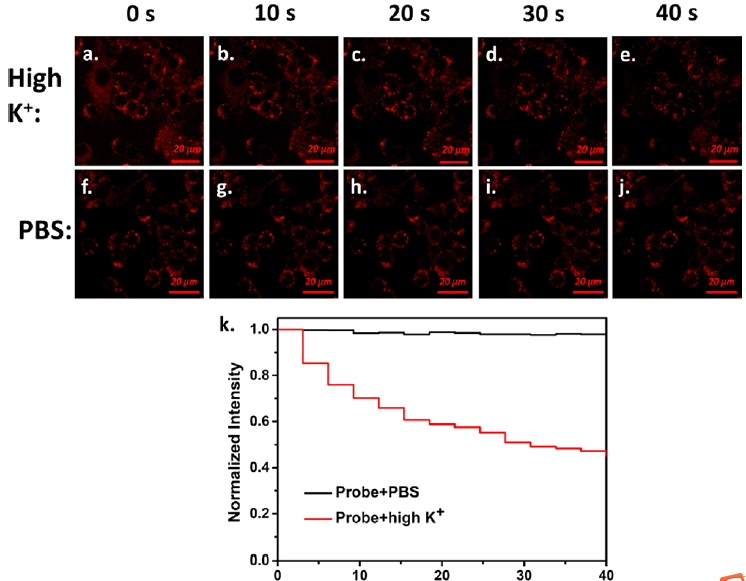
图3. (a - e)高K+(100 μL)的PC12细胞在红色通道(0−40 s), (f - j)含PBS的PC12细胞在红色通道(0−40 s),(K)含PBS的PC12细胞在0−40 s (λex= 561 nm, bar = 20 μm)。
作为一种长波长的红色荧光探针,我们将其用于脑组织的标记。对TH和DBH或DBH和PNMT进行双重免疫标记是一种成功有效的方法。作者首先使用兔抗酪氨酸羟化酶多克隆抗体和抗多巴胺β-羟化酶,随后使用山羊抗兔IgG/Cy3二抗混合物和山羊抗小鼠IgG/ALexa Fluor 35030分钟,然后用探针(10 μM)染色120分钟。对于PNMT和DBH双标记实验,切片用兔抗PNMT多克隆抗体和抗多巴胺β-羟化酶2 h后,加入山羊抗兔IgG/Cy3二抗混合物(和山羊抗小鼠IgG/ALexa Fluor 350 30分钟,然后用探针(10 μM)染色120分钟。如图4所示,探针(b1, b2)和DBH-AF350 (c1,c2)的荧光发射区域有广泛的重叠(e1, e2),表明探针对去甲肾上腺素能神经元具有特异性的标记能力。同时,通过DBH和PNMT的双重免疫标记,仍然显示探针特异性地标记去甲肾上腺素高于肾上腺素(图5)。这种双向检测策略有力地证明了探针能够在组织水平上有效地、特异性地标记去甲肾上腺素。

图4。(a1, a2) cy3标记TH阳性区域的免疫荧光。(b1, b2)探针标记的脑组织。(c1, c2)免疫荧光AF350标记DBH阳性区域。(d1) a1和b1的合并图像。(d2) a2和b2合并后的图像。(e1) b1和c1的合并图像。(e2) b2和c2合并图像(Cy3:λex= 548 nm。AF350: λex= 405 nm。探针:λex= 561 nm。Bar = 200μm)。

图5. (a1, a2) cy3标记PNMT阳性区域的免疫荧光。(b1, b2)探针标记的脑组织。(c1, c2)免疫荧光AF350标记DBH阳性区域。(d1) a1和b1的合并图像。(d2) a2和b2合并后的图像。(e1) b1和c1的合并图像。(e2) b2和c2合并图像(Cy3:λex= 548 nm。AF350:λex= 405 nm。探针:λex= 561 nm。Bar = 200μm)。
由于探针的波长较长,成像的穿透深度总是受到波长的限制,有效地补充了荧光成像的局限性,进行了活体荧光成像。在小鼠背部右侧注射探针(20 μM),然后注射去甲肾上腺素200 μM)在同一区域注入。在小鼠背部另一侧注射20 μM探针和与NE体积相同的PBS。如图6所示,信号NE组的红通道随时间增加而增加,而对照组则无明显变化。我们认为该探针可作为体内NE检测的有效工具,在神经递质和信号通路的定量分析方面具有良好的临床应用前景。
氟西汀作为一种选择性5 -羟色胺再摄取抑制剂,可以增强5 -羟色胺的神经传递,产生与氟西汀一样的抗抑郁作用,它还可以增加下丘脑、皮质、皮质和前额叶皮质中的多巴胺和细胞外去甲肾上腺素水平,作者进行了氟西汀干预下去甲肾上腺素释放显像实验。我们给大鼠腹腔注射氟西汀(10mg /kg),手术暴露大脑40 min后,将探针(200 μM)直接注入大脑成像。与老鼠同样体积的生理盐水腹腔内,老鼠用氟西汀治疗大脑中去甲肾上腺素水平明显高于对照组(图7),为临床抗抑郁药物的筛选和疗效评估提供新的研究手段。
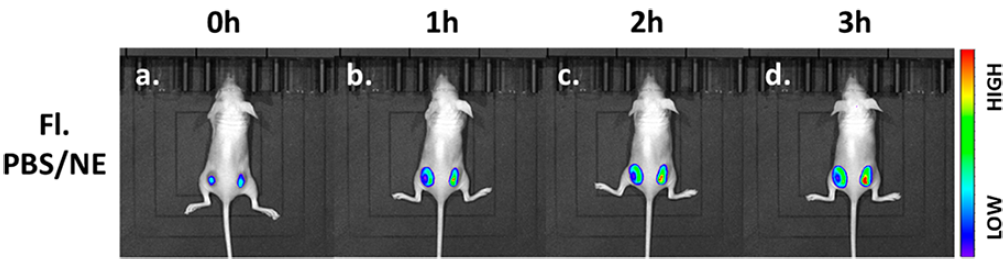
图6. 注射PBS/NE (λex= 561 nm)的小鼠体内荧光成像。

图7. (a−c)腹腔注射生理盐水的大鼠体内成像。(d - f)腹腔注射氟西汀(10 mg/kg)的大鼠体内成像。(g)大鼠注射ROIs、生理盐水和氟西汀的荧光强度(λex= 561 nm)。
结论
作者采用离开保护荧光团基团产生分子内PET效应,没有荧光发射。随后,利用NE独特的氨基乙醇结构单元,通过级联亲核和离开反应,发生脱保护和荧光团释放。利用长波长红光荧光探针,我们通过细胞成像、切片成像和体内成像验证了探针在复杂生物环境中对NE的特异性响应。作者应用该探针对高K+刺激下去甲肾上腺素胞饮信号通路进行荧光成像,并观察到抗抑郁药物对去甲肾上腺素干预的效果。
参考文献
Na Zhou, Fangjun Huo, Yongkang Yue, and Caixia Yin*, Specific Fluorescent Probe Based on “Protect−Deprotect” To Visualize the Norepinephrine Signaling Pathway and Drug Intervention Tracers, J. Am. Chem. Soc., J. Am. Chem. Soc. 2020, 142, 17751−17755. DOI: 10.1021/jacs.0c08956. https://pubs-acs-org-s.z.library.sh.cn/doi/10.1021/jacs.0c08956
产品提供
| 序号 | 新闻标题 | 浏览次数 | 作者 | 发布时间 |
|---|---|---|---|---|
| 1 | 抗氧化小分子70831-56-0,菊苣酸Cichoric Acid,6537-80-0的制备过程 | 1033 | 瑞禧生物 | 2023-03-30 |
| 2 | 活性氧ROS小分子Dapsone,cas:80-08-0,氨苯砜的制备过程-瑞禧科研 | 935 | 瑞禧生物 | 2023-03-30 |
| 3 | HBPS-N3,Azide-PEG-HBPS,叠氮化超支化聚苯乙烯高分子聚合物的制备过程 | 1079 | 瑞禧生物 | 2023-03-17 |
| 4 | l-PS-PhN3,Azide叠氮Azido偶联线性聚苯乙烯双链的制备过程 | 962 | 瑞禧生物 | 2023-03-17 |
| 5 | N3-PS-N3,Azido-PS-Azido/Azide,双叠氮官能团修饰聚苯乙烯的制备方法 | 915 | 瑞禧生物 | 2023-03-17 |
| 6 | PS-N3,Azido-PS,叠氮Azide修饰聚苯乙烯/高分子聚合物的制备过程 | 1122 | 瑞禧生物 | 2023-03-17 |
| 7 | Azido-PEG2-t-Butylester/1271728-79-0,叠氮N3/ZAD修饰叔丁酯化合物的制备方法 | 949 | 瑞禧生物 | 2023-03-14 |


 400-115-0588
400-115-0588 在线咨询
在线咨询







 库存查询
库存查询