- 029-86354885
- 18392009562

内容提要
通过将NO结合的Fe−S团簇掺入脱铁蛋白腔体,构建了具有高负载效率的光活性NO释放系统。该系统保持了完整的核-壳结构,显示具有强的稳定性、降低细胞毒性、高效的细胞摄取和光控NO释放等优点。
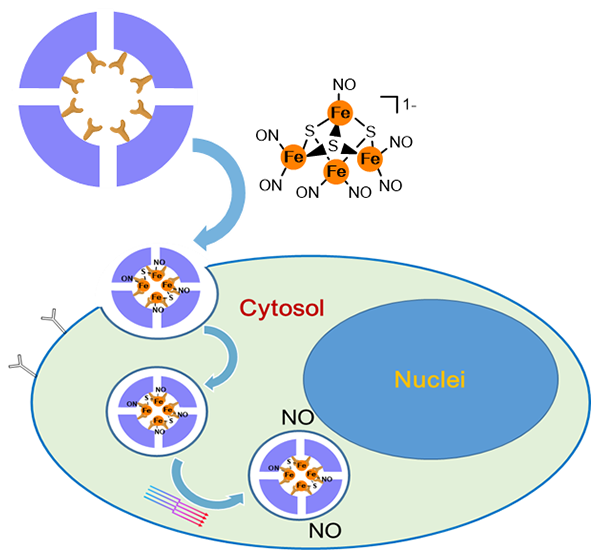
前言
NO作为第一个被发现的气体信号分子,已被证实参与神经传递、心血管活动和免疫系统。NO在疾病过程中的积极和消极作用,如**生长或抑制,与NO的产生水平和细胞敏感性密切相关。通过外源性NO作为治疗药物递送到活的恶性细胞,可以干扰NO介导的信号转导或**进展和转移的病理途径。但是,外源NO的治疗效果受其半衰期短和对生物物质的易变性的限制,这个问题传统是通过NO供体来解决,如壬酸盐和s-亚硝基硫醇衍生物,这些供体在生理条件下不稳定,释放气态NO。为了满足空间和时间控制NO释放的关键要求,光活性NO供体可以利用光作为受控激活的触发器。天然脱铁蛋白因其可逆重组特性和对过表达转铁蛋白受体的**细胞的特异性结合亲和力而独特,直径约为8 nm的大空腔允许客体分子大量聚集,已经成为药物传递、细胞成像、纳米反应器的理想平台。本论文将脱铁蛋白与路森黑盐(RBS)耦合,构建一个多重NO结合的铁-硫簇/蛋白质复合物,在不需要内表面工程的情况下提高负载能力,光控NO释放,高NO供应水平,Fe-NO解离后细胞毒性铁离子的保留,促进细胞内内化。
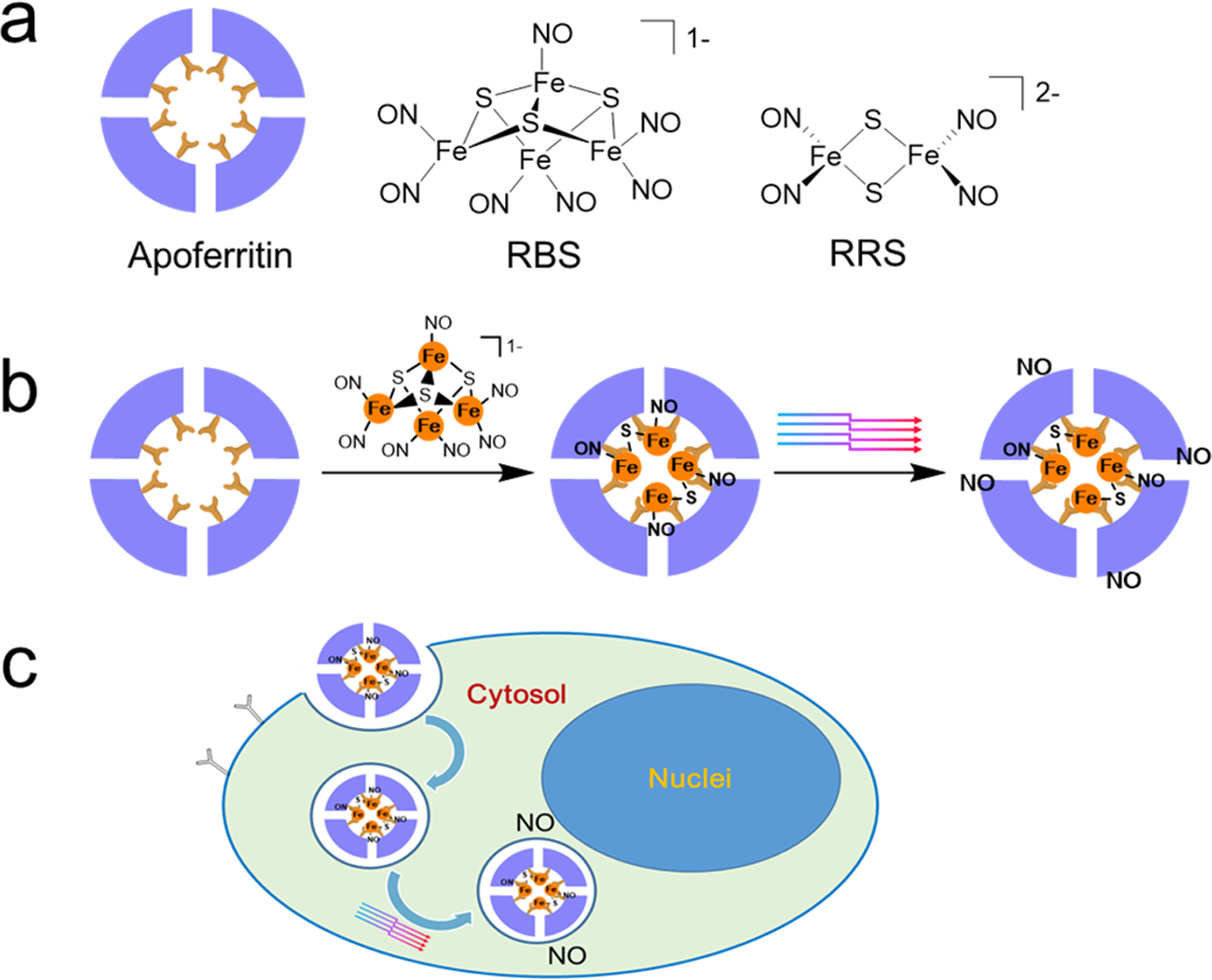
图1. (a)脱铁蛋白及其RBS和RRS化学结构示意图;(b) RBS嵌入和光诱导NO释放的说明;(c)RBS/蛋白复合材料胞内内化和光诱导胞内NO释放的示意图。
在pH恒定为7.4的10%乙腈/PBS缓冲液中,以铁原子与蛋白质的摩尔比为500:1,将RBS负载到脱铁蛋白中。用10%乙腈/PBS透析,再用PD-10柱纯化,得到一个棕色的RBS-蛋白复合物(RBS-NP)溶液。通过KMnO4氧化法和电感耦合等离子体发射光谱(ICP-OES)分析,估计每个蛋白质的Fe负载量分别为213和201个原子。以醋酸铀酰为阴性染色剂,通过HR-TEM证实了RBS-NP完整的结构,与脱铁蛋白相似,显示透明的外壳和致密的核被醋酸铀酰染色(图2a)。非染色的HR-TEM,RBS-NPs可见为与蛋白腔大小相当的斑点(图2a)。在笼内大量积累了RBS,可能是由于Fe - S簇与组氨酸、精氨酸和色氨酸等氨基酸残基的相互作用以及笼内疏水环境。RBS-NPs的平均水合直径略大于脱铁蛋白(12.9±2.6 nm vs 10.0±0.9 nm)。如图2c所示,圆二色(CD)光谱中193 nm处的正峰和208、222 nm处的负峰均为常数(图2c),说明RBS掺入过程确保了蛋白壳的α-螺旋和β片保持在原始状态。
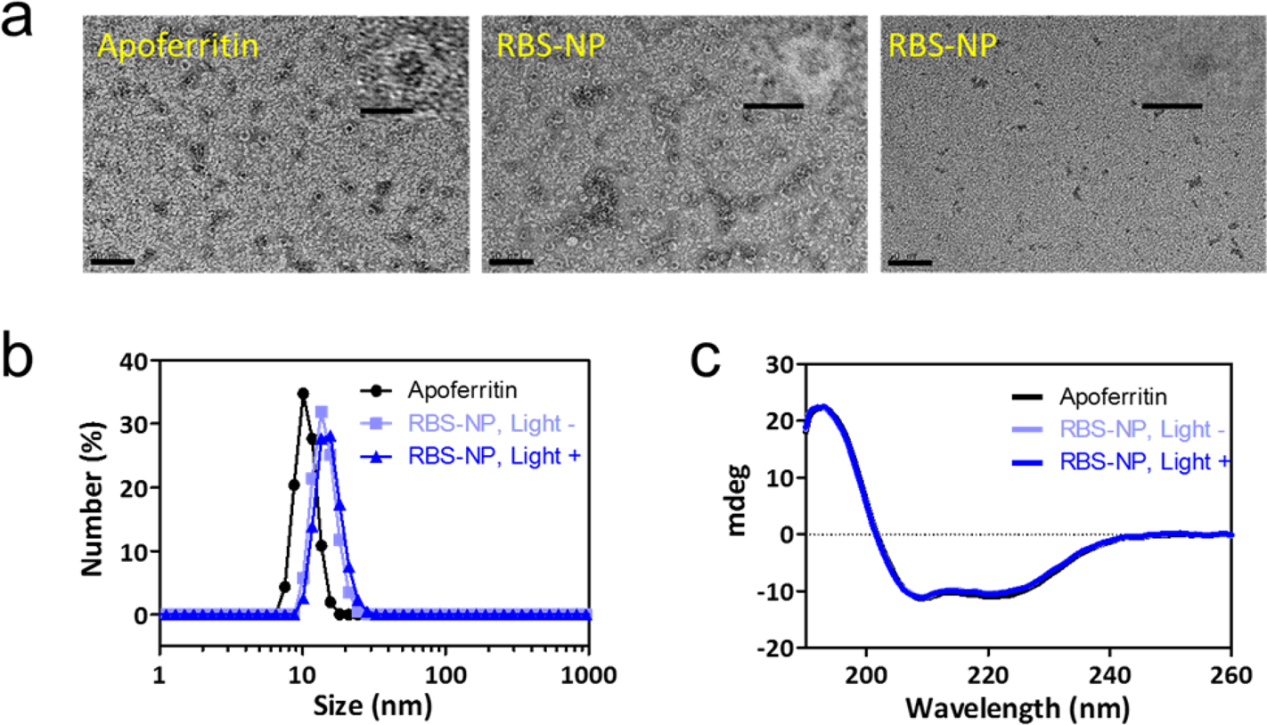
图2. (a) 醋酸铀酰染色的脱铁蛋白和RBS-NP,以及未染色的RBS-NP的HR-TEM图像(标尺为50 nm,内径为10 nm);(b)脱铁蛋白、RBS-NP和光处理RBS-NP的DLS分析;(c)脱铁蛋白、RBS-NP和光处理RBS-NP的CD光谱。
白光LED照射(12 mW/cm2, 60 min)使NO完全释放后,RBS在320 ~ 500 nm范围内的吸收带在PBS (pH 7.4)中消失。光照射引起了RBS-NP的吸收光谱相同的变化,这表明Fe−NO键被掺入过程打断,并保持了光活性(图3a)。RBS和RBS-NP的NO积累呈线性时间依赖性,其稳定速率分别为4.6 μM/min和3.3 μM/min(图3b)。由于RBS在水介质中的稳定性有限,即使小心地保护不受光,在RBS溶液中也很容易检测到NO。在RBS-NP溶液中,初始NO水平明显降低,表明RBS在疏水环境中笼化提高了RBS的稳定性。因此,RBS-NP可作为一种光控释放NO的平台而不会对笼状结构造成损伤。
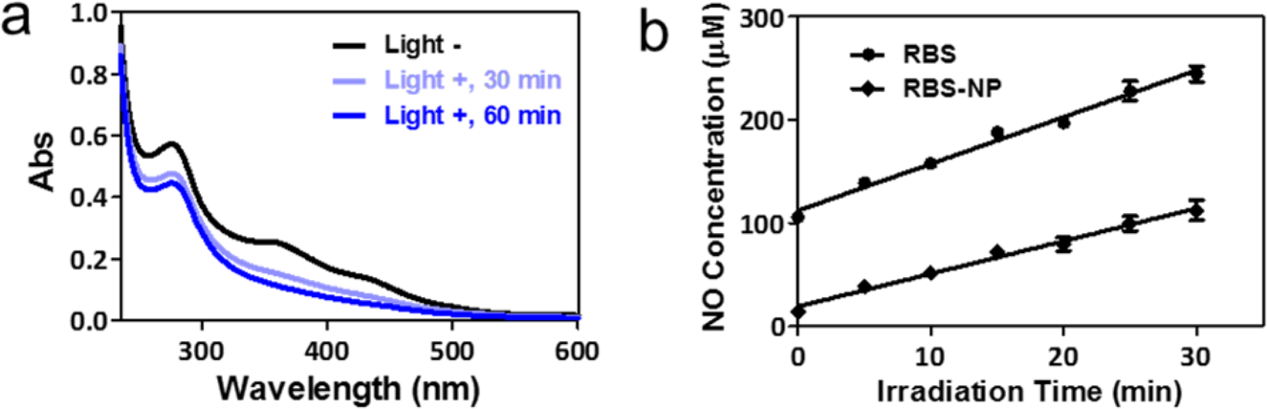
图3. (a) RBS-NP在光照前后的吸收光谱;(b)由RBS和RBS- np产生的NO浓度随光照时间的变化曲线。
因为Fe - S团簇被笼化而不是被脱铁蛋白外壳吸收,所以脱铁蛋白材料的细胞内化不会受到Fe - S团簇的影响。作者对两种**细胞系HeLa和MCF-7进行了体外光活性和毒性实验。RBS-NP 16 h的细胞培养,用PBS洗涤,DCF-FM DA染色,白光LED曝光(12 mW /cm2) 30分钟。在荧光显微镜下,RBS-NP处理的HeLa细胞的亮绿色图像反映了有效的细胞摄取和光诱导的NO释放(图4a)。经过RBS或RBS-NP处理的MCF-7细胞和光处理后,其荧光强度明显降低,可能是由于细胞内清除反应的存在缩短了NO寿命。为了研究细胞反应是否与细胞内氧化应激水平有关,我们使用荧光反应氧物种(ROS)探针DCFH-DA对H2O2处理的HeLa和MCF7细胞进行了成像,无论光照与否。光暴露不影响ROS水平。与HeLa细胞不同,MCF-7细胞在H2O2的作用下表现出ROS水平的抑制,而HeLa细胞则表现出细胞内ROS水平的升高。因此,氧化应激反应似乎存在细胞类型依赖机制。
MTT法测定了RBS和RBS-NP在黑暗条件下的细胞毒性。在0.5、1、2、3、4、6、8和10 μg/mL铁浓度下,分别用RBS或RBS-NP处理HeLa和MCF细胞48 h,然后进行MTT实验。在HeLa细胞中,RBS和RBS-NP的IC50值分别为3.7和5.4 μg/mL Fe(图4b)。在MCF-7细胞中,也观察到相对于RBS,暗色RBS-NP的细胞毒性降低。对于正常细胞,RBS和RBS-NP在人肝细胞QSG细胞上表现出类似的铁浓度依赖性的存活率,IC50值增加到约10 μg/mL。此外,研究了NO释放对HeLa和MCF-7细胞的光毒性作用。细胞治疗与RBS或RBS-NP铁剂量为1.0μg/mL 16 h,然后被白光LED曝光(12 mW/cm2)不同分钟(0、5、10、15、20、25、30分钟),与PBS再孵育24小时。如图4c所示,用脱铁蛋白处理HeLa细胞,或光处理,或暗处理RBS,或暗处理RBS-NP均不影响细胞活力。RBS或RBS-NP处理过的MCF-7细胞表现出更高的光照耐受性,这是由于上述MCF-7细胞中细胞内氧化应激的抑制。细胞以不同的途径吸收RBS和RBS-NP。小尺寸疏水的RBS具有细胞膜通透性,而RBS-NP只能通过受体介导的内吞作用内化,导致铁摄取速率的差异。HeLa和MCF细胞治疗由RBS和在同一初始RBS-NP铁浓度(3μg/mL)在无血清培养基远离光1或2 h。对于HeLa细胞,在孵育后1 h和2 h, RBS-NP处理导致铁的摄入量分别比RBS多14和5.3%;对于MCF-7细胞,在1和2小时内,RBS-NP处理比RBS分别增加了18和12%的铁摄入量。因此,RBS的吸收可以通过笼状策略增强。
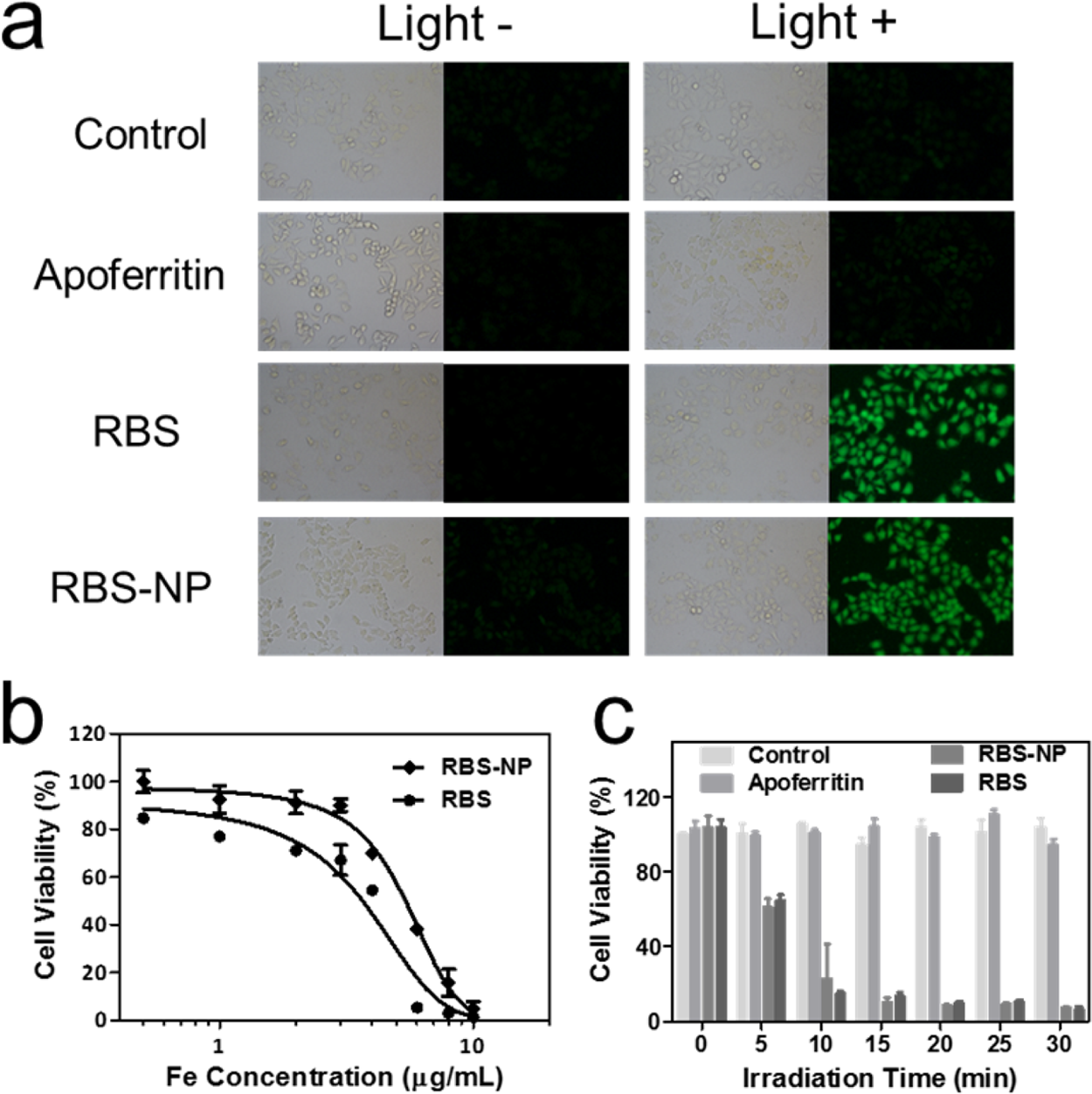
图4。(a)使用DCF-FM DA作为NO探针,在光照前和光照后使用RBS或RBS-NP处理的HeLa细胞的荧光图像;(b)不同Fe浓度下RBS和RBS- np处理HeLa细胞的MTT分析;(c)不同照射时间下,脱铁蛋白或RBS或RBS- np处理的HeLa细胞的MTT分析。
结论
作者在pH 7.4下将光活性Fe-S团簇加入脱铁蛋白的笼子内部,避免了传统的蛋白质分解重组过程。体积庞大的RBS复合物以42%的负载效率封装。疏水蛋白笼对水敏感的RBS具有显著的稳定性,纳米级复合材料可保存在PBS缓冲液中,且至少有2个月的保质期。RBS复合材料的高效细胞摄取和光控NO释放特性允许细胞类型依赖性的药物应用于基于NO的治疗。
参考文献
Xiao Li, Yajie Zhang, Jian Sun, Weijian Chen, Xuewei Wang, Fenli Shao, Yuyu Zhu, Fude Feng* , Yang Sun*,Protein Nanocage-Based Photo-Controlled Nitric Oxide Releasing Platform, ACS Appl. Mater. Interfaces, 2017, 9, 19519−19524. DOI: 10.1021/acsami.7b03962. https://pubs.acs.org/doi/10.1021/acsami.7b03962
产品提供
| 序号 | 新闻标题 | 浏览次数 | 作者 | 发布时间 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 837 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 862 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基与NHS活性酯反应PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1639 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid叠氮八聚乙二醇羧酸 | 774 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 877 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮缩硫醇-聚磷酸酯 PPE-TK | 936 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙键响应性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 913 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在线咨询
在线咨询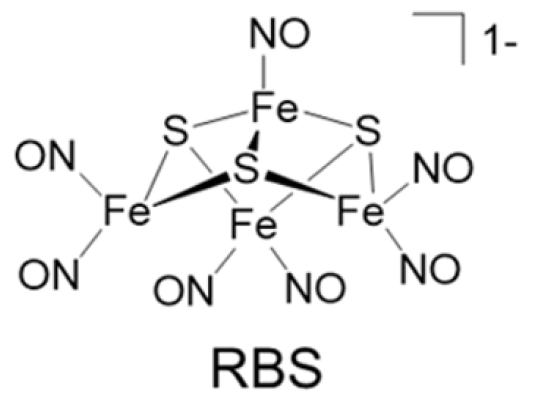








 库存查询
库存查询