- 029-86354885
- 18392009562

内容提要
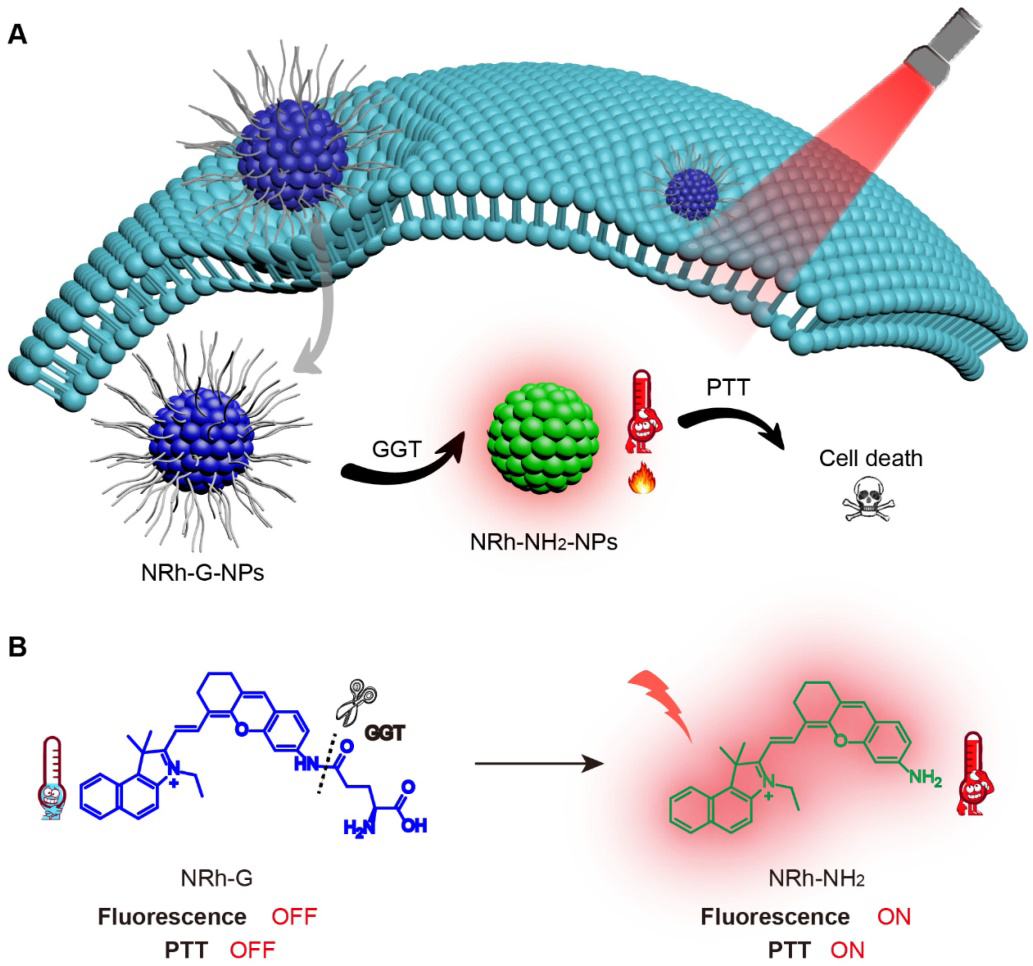
**的精确治疗越来越受到重视。γ-谷氨酰转肽酶(GGT)是**中显著上调表达的生物标志物。作者开发了一种GGT响应的近红外(NIR)纳米粒子,用于**特异性荧光成像引导的光热治疗。GGT响应性近红外探针NRh-G自发聚集成纳米粒子NRh-G-NPs。该纳米粒子经与GGT特异反应荧光增强约180倍,并表现出良好的光热效应。在激光照射下,NRh-G-NPs可以选择性地照亮U87MG**细胞并进行消融。在荷瘤小鼠体内静脉注射NRh-G-NPs后,NRh-G-NPs可以到达**区域并特异地照亮**,对U87MG**中过表达的GGT有特异性反应,选择性地照亮**进行成像引导治疗。在激光照射后,**可完全清除,40天内无**复发。
前言
癌症对人类健康和生命构成重大威胁。除手术、放疗、化疗等多种癌症治疗方法外,光热疗法(PTT)近年来因其高疗效和特异性而备受关注。在光热转换剂的帮助下,光照射被吸收并转化为热量,以最小的副作用破坏癌组织。理想的光热转化剂应该是无毒的,具有高**靶向性和高效的光热转化能力。自成像能力是识别光热剂积累的首选更好地指导激光手术窗口和剂量。在各种光热制剂中,有机染料因其排泄快、生物相容性好、临床转化能力强而备受关注。基于花菁和二酮吡咯的有机染料在近红外(NIR)光激发下具有更高的穿透深度,因此代表了**治疗领域的研究热点。近年来,智能纳米系统的诊断和治疗功能可以通过**微环境(如pH、缺氧、酶)或外部刺激(如光、超声、磁)在**区域选择性激活,具有更高的治疗选择性和效率。本研究通过响应GGT的近红外花菁荧光团(NRh-G)在水中自发聚集成纳米粒子NRh-G-NPs,在正常生理环境下保持OFF状态,而在过表达GGT的**细胞中NRh-G-NPs上的γ-Glu部分被特异性识别并被切断开启了荧光和光热能力,从而最大限度地提高了治疗的特异性和准确性。
结果与讨论
NRh-G的结构由GGT特异性底物γ-Glu和近红外花菁荧光团NRh-NH2组成。氨基酸γ-Glu作为GGT识别底物被广泛应用,可被GGT特异性识别和切割。NRh- NH2在740 nm处具有较强的荧光,随后与Boc-Glu-OtBu反应生成中间产物NRh-G-Boc,通过Boc脱保护反应生成最终产物NRh-G(图1A)。NRh-G-NPs进入GGT高表达环境后,γ-Glu部分被特异性识别并裂解。将NRh-G-NPs转化为NRh-NH2-NPs,在714 nm处有近红外吸收峰,在740 nm处有荧光恢复(图1B)。TEM图像显示单分散的NRh-G-NPs,尺寸约为50 nm(图1C)。经GGT处理后,NRh-NH2-NPs的大小减小到20-30 nm。DLS测量的水动力学尺寸从90 nm (图1D)降至70 nm,Zeta电位也从-0.3 mV(图1D)改变到6.0 mV。用GGT处理30分钟,在714 nm处出现紫外吸收峰(图1E)。随着孵育时间(0 ~ 30 min,图1F)和GGT浓度(0 ~ 1.0 U/L,图1G)的增加,740 nm处的荧光发射逐渐增加。
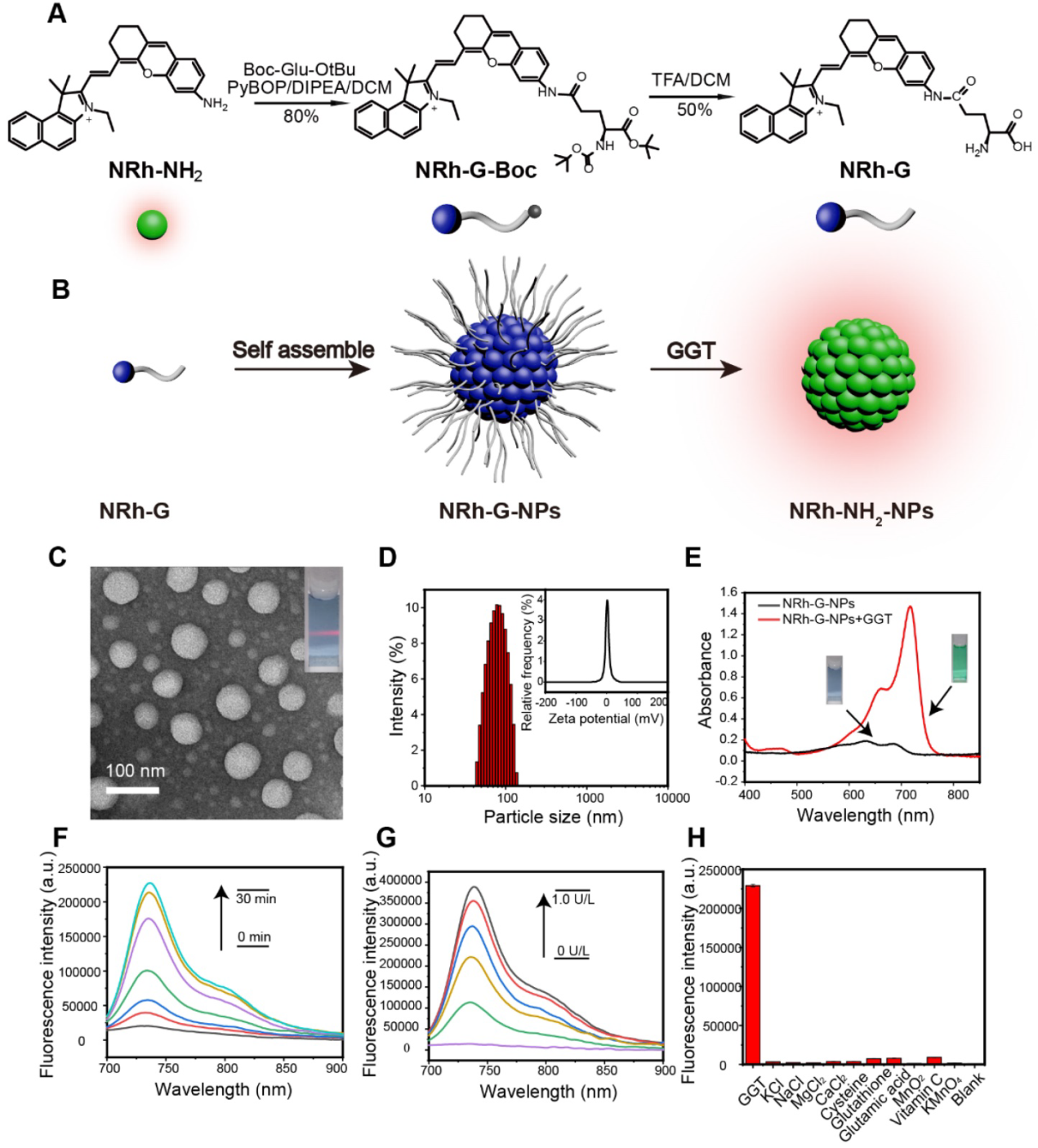
图1。(A) NRh-G的化学结构和合成步骤。(B) NRh-G自组装形成NRh-G-NPs,然后被GGT切割形成NRh-NH2-NPs发出荧光。(C)纳米粒子的TEM图像。(D)通过动态光散射(DLS)测量的纳米颗粒的水合粒径和zeta电位。(E) NRh-G-NPs (5.8 µg/mL)与GGT (0.4 U/L)反应前后溶液的紫外吸收光谱。(F) GGT (0.4 U/L) 0 ~ 30 min, NRh-G-NPs (5.8 µg/mL)的荧光光谱变化。(G)不同浓度的GGT (0 ~ 1.0 U/L)孵育30 min后,NRh-G-NPs(5.8 µG /mL)的荧光光谱变化。(H) NRh-G-NPs (5.8 µg/mL)对GGT (0.4 U/L)以及其它干扰物种 (0.5 mM)的荧光强度。
NRh-G-NPs在U87MG细胞中的细胞毒性表明,不同浓度的NRh-G-NPs在0 ~ 57.6 μg/mL范围内的细胞存活率均超过90%,表明NRh-G-NPs适合用于活细胞成像。用NRh-G-NPs检测活细胞中GGT的活性。首先,在NRh- G-NPs作用下,U87MG细胞的荧光随时间逐渐增强,在20分钟左右达到稳定值(图2A)。作者用特定的GGT抑制剂(azaserine)对U87MG细胞进行预处理,然后与NRh-G-NPs (5.8 μg/mL)孵育20分钟,经抑制剂预处理的细胞的荧光信号明显下降(图2B)。当高酶表达的U87MG细胞与NRh-G-NPs孵育20 min时,观察到强烈的荧光信号。而相同时间的NRh-G-NPs处理低酶表达L02细胞显示出较弱的荧光。当L02细胞用GGT促进剂预处理,然后与NRh-G-NPs共孵育20分钟时,观察到荧光信号增强(图2C)[59]。因此,NRh-G-NPs可以区分正常细胞和癌细胞,而且确实具有GGT特异性。由于GGT是氧化应激的早期敏感标记物,作者研究了GGT与潜在的抗癌药物NaBu协同诱导细胞氧化应激的作用。预处理细胞中NaBu浓度越高,与NRh-G-NPs孵育后的荧光强度越强。同时,高浓度NaBu预处理后死细胞比例显著增加。因此,抗癌药物NaBu和NRh-G-NPs可以同时用于癌症的诊断和治疗。
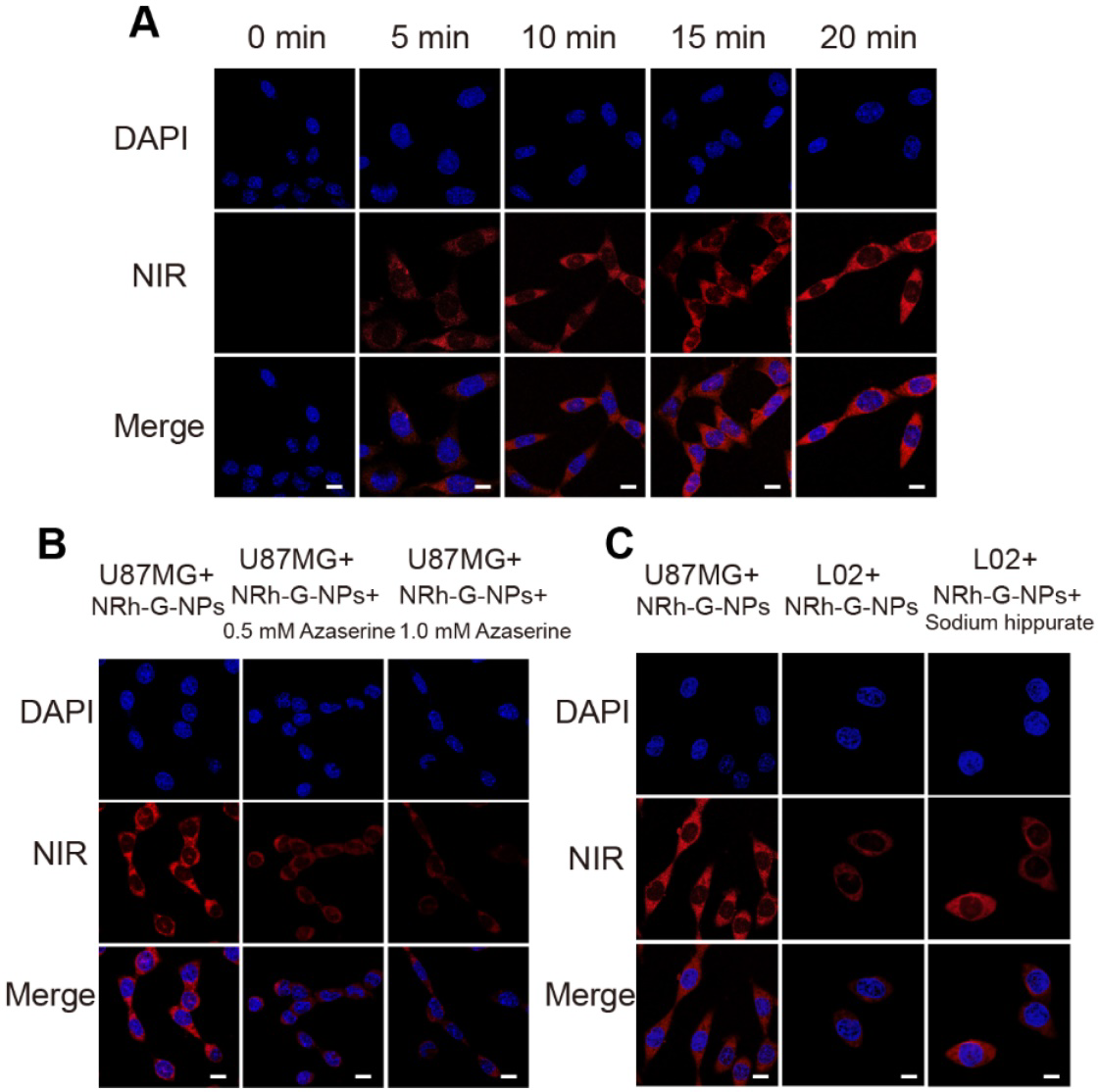
图2。(A) NRh-G-NPs(5.8µg/mL)孵育0、5、10、15、20分钟U87MG细胞的荧光共聚焦图像。(B) NRh-G-NPs(5.8µg/mL)孵育U87MG细胞的荧光共聚焦图像;NRh-G-NPs(5.8µg/mL)孵育GGT抑制剂预处理的U87MG细胞的共聚焦荧光图像。(C) NRh-G-NPs(5.8µg/mL)孵育U87MG细胞和L02细胞的共聚焦荧光图像;NRh-G-NPs (5.8µg/mL)孵育的GGT促进剂预处理(1.0 mM) L02细胞共聚焦荧光图像。比例尺:10 µm。
通过尾静脉将纳米颗粒注射到U87MG荷瘤裸鼠体内,评价NRh-G-NPs对体内**的被动靶向能力。采用生物发光成像系统监测全身荧光。从图3A可以看出,在注射NRh-G-NPs的小鼠**中,荧光逐渐增加,在1.5 h时荧光最强,随后在注射5h后荧光开始减弱并完全消失。定量分析显示,注射NRh-G-NPs的小鼠的信噪比(SNR)在1.5 h内显著上升,然后开始下降。注射NRh-G-NP 1.5 h后解剖小鼠,切除心脏、脾脏、**、肺、肠、肾、肝进行生物成像。与其他器官相比,**的荧光非常强。切片**组织后也进行共聚焦成像(图3C)。对深度为35 μm的U87MG**组织切片进行三维重建。结果表明,NRh-G-NPs通过被动靶向**定位,可用于**中GGT的有效实时无创成像。
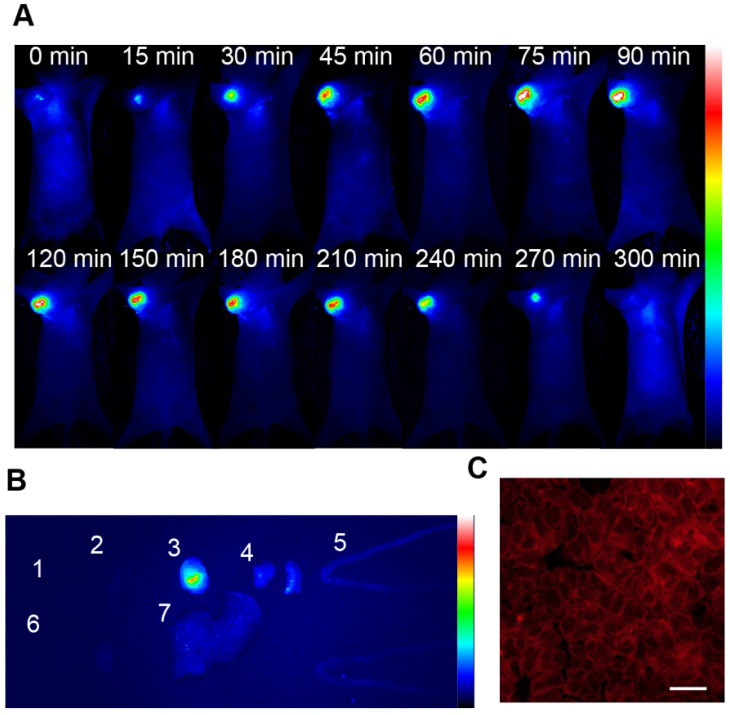
图3。(A)通过尾静脉注射NRh-G-NPs (2.9 mg/mL)后小鼠的实时荧光图像。(B)小鼠尾静脉注射NRh-G-NPs 1.5 h后,从U87MG荷瘤小鼠中切除的心脏(1)、脾脏(2)、**(3)、肺(4)、肠(5)、肾(6)和肝(7)的荧光图像。(C) U87MG**组织切片深度在35µm之间的共聚焦z扫描成像切片。标尺: 100µm。
当GGT特异性切断NRh-G-NPs的氨基酸链时,产物NRh-NH2-NPs在730 nm激光照射下表现出光热效应和730 nm激光照射下的光热效应(图4A)。不同浓度的NRh-G-NPs加入或不加入1.0 U/L酶孵育20 min,然后在730 nm (1.0 W/cm2)激光照射下孵育5min。激光照射下,未加GGT处理的不同浓度NRh-G-NPs的温度没有明显变化(图4B)。而在相同激光照射条件下,酶培养后的升温速度和最终达到的温度与NRh-G-NPs的浓度成正比(图4C)。图4B和图4C中的NRh-G-NPs (34.6 μg/mL)在730 nm激光照射5分钟后的红外热像图如图4D,同时也证实了NRh-NH2-NPs具有良好的光热稳定性。不同浓度的NRh-NH2在730 nm激光照射5分钟,通过监测了温度的变化,NRh-G-NPs与GGT的反应产物具有优良的光热性能。
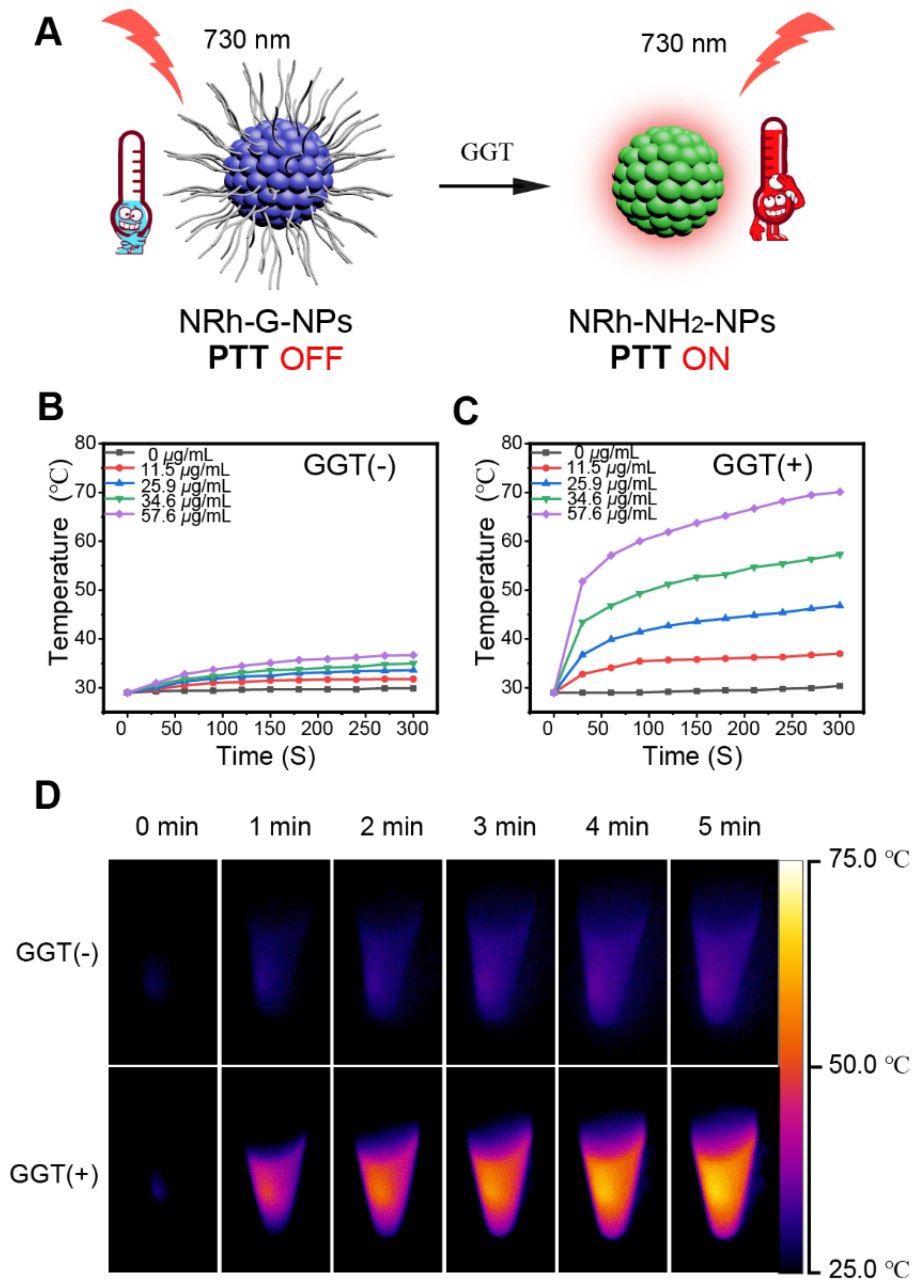
图4。(A)光热特性开启示意图。(B)不同浓度NRh-G-NPs(0、11.5、25.9、34.6、57.6 µg/mL)在730 nm (1.0 W/cm2)光照5分钟后的温度曲线。(D)无GGT孵育和有GGT孵育的NRh-G-NPs (34.6 µg/mL)的红外热像图。
NRh-G-NPs对U87MG癌细胞无明显的细胞毒性,即使在高达57.6 μg/mL的蛋白浓度下也无明显的细胞毒性,作者使用730 nm激光照射不同浓度的NRh-G- NPs孵育的细胞。随着NRh-G-NPs浓度的增加,细胞存活率显著降低(图5A)。激光照射后NRh-G-NPs孵育细胞的死亡率较高,GGT抑制剂预孵育后细胞死亡率下降(图5B, 5C)。因此,钙黄素和碘化丙啶共染色细胞的MTT检测和倒置荧光成像进一步证实了NRh-G-NPs对U87MG细胞的有效和特异性光热消融作用,在特定条件下能体外杀伤**细胞。
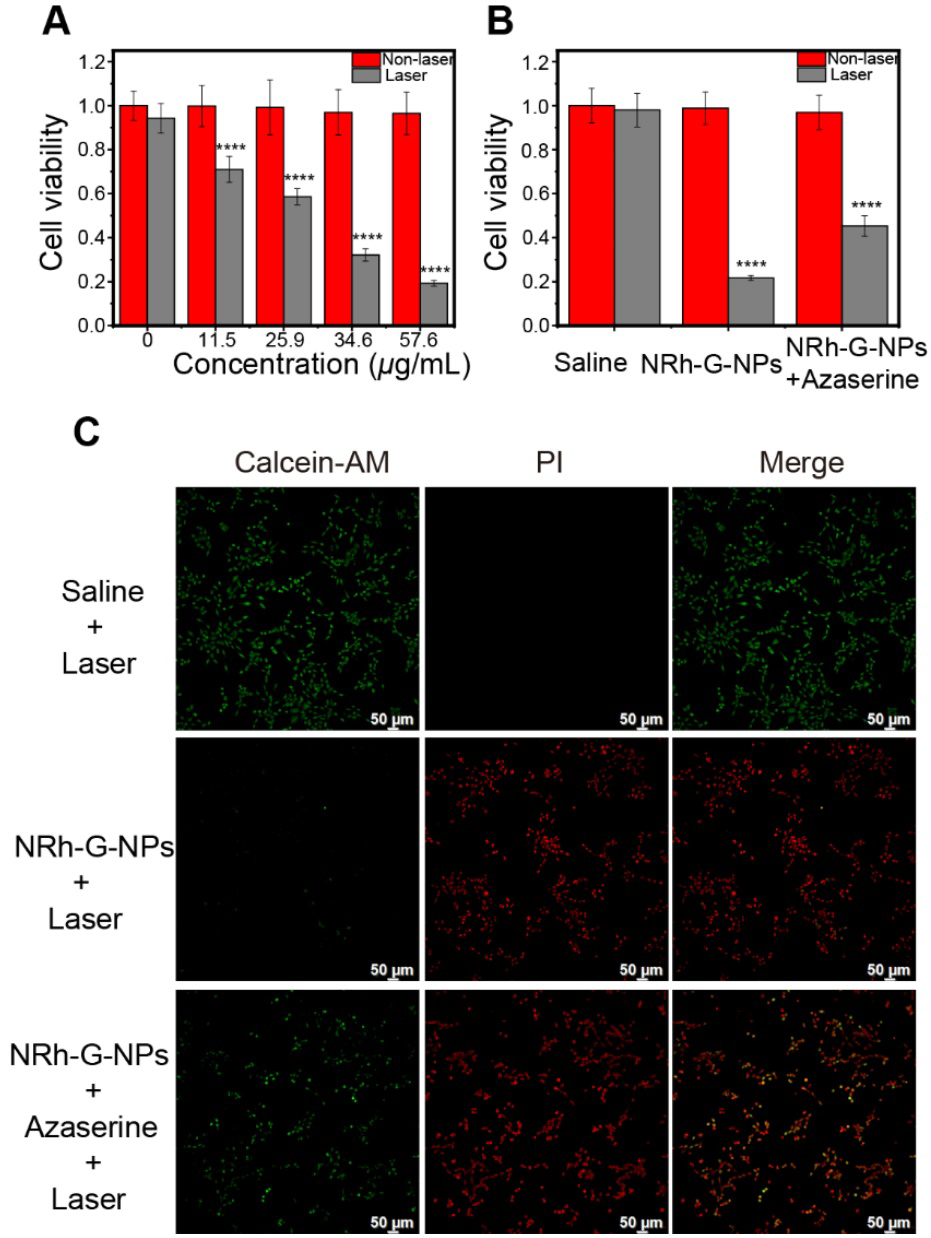
图5。(A)在730 nm激光(1.0 W/cm2)照射下,不同浓度的NRh-G-NPs诱导U87MG细胞的相对存活率。(B)不同孵育条件下随730 nm激光(1.0 W/cm2)孵育U87MG细胞的细胞毒性。(C) 不同孵育条件下U87MG细胞,经钙绿素AM/PI染色后,置于730 nm激光(1.0 W/cm2)照射前的倒置荧光图像。
基于NRh-G-NPs在体内对**的被动靶向及其强近红外吸收,我们在小鼠U87MG细胞皮下**模型上进行了体内光热治疗的研究(图6A)。采用红外热像仪每隔1 min直接监测小鼠体温。在静脉注射NRh-G- NPs或生理盐水1.5 h后,小鼠暴露于730采用红外热像仪监测温度(图6B)。注射NRh-G-NPs的小鼠,在激光照射下**表面温度从36°C迅速上升到54°C。在相同的照射条件下,其他各组小鼠的**温度没有明显变化(图6D)。H&E染色的**切片组织学检查显示,在激光照射后,只有NRh-G-NPs注射组的**结构严重受损(图6C)。治疗组(NRh-G-NPs +激光)小鼠**经过2天的光热治疗完全消融,观察期间未见**再生。注射生理盐水或NRh-G-NPs,或仅注射相同功率的激光照射对**生长没有影响(图6E)。治疗后1天解剖**的照片显示, NRh-G-NPs + Laser组**明显缩小,而其他三组**体积增大。治疗14 d后,4组小鼠均处死,切取主要脏器进行H&E染色。结果显示,器官没有受到任何明显的损伤。四组小鼠的体重也没有异常变化(图6F)。与3个对照组的平均寿命相比,经过NRh-G-NPs诱导的光热治疗的小鼠存活超过40天(图6G)。NRh-G-NPs可以在动物模型中有效、准确地治疗**而不损伤其他器官。
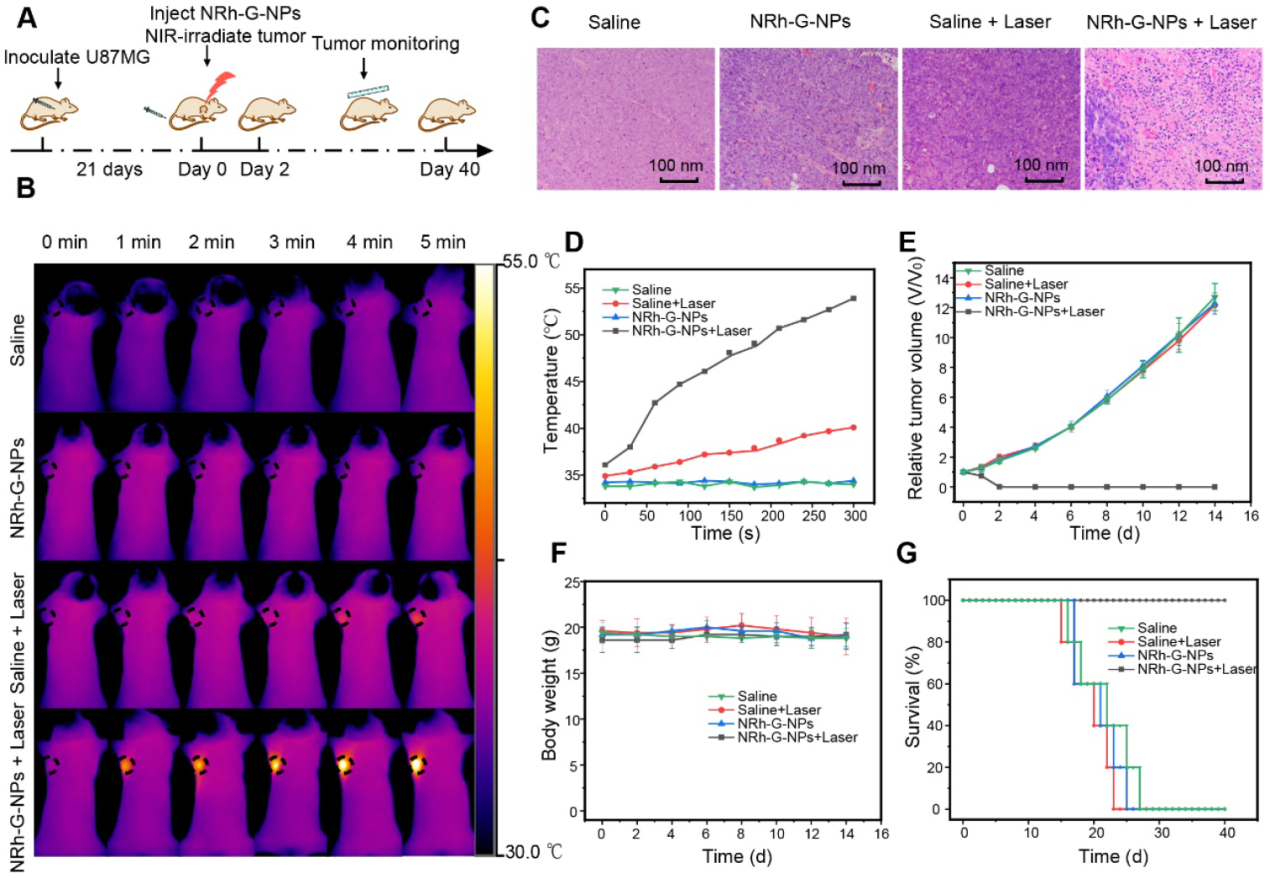
图6。(A)光热治疗流程图。(B) U87MG荷瘤小鼠静脉注射生理盐水或NRh-G-NPs (2.9 mg/mL)的红外热像图;对U87MG荷瘤小鼠在730 nm激光(1.0 W/cm2)照射下静脉注射生理盐水或NRh-G-NPs (2.9 mg/mL)的红外热像图。(C) H&E染色治疗组和其他三个对照组的**切片。(D)根据(B)中红外热像数据得出的**温度变化。(E)不同治疗组小鼠的**生长曲线。(F)各组小鼠体重。(G)不同治疗组小鼠的存活率。
结论
作者合成了一种能特异性检测和治疗恶性**的γ-谷氨酰转肽酶激活的近红外纳米粒子NRh-G-NPs,在血液循环过程中不表现出荧光或光热效果。EPR效应导致**高聚集,被**部位高表达的酶GGT激活,生成的NRh-NH2-NPs显示出强大的荧光发射,可用于**诊断,并在光热治疗中显示出优异的光热转换特性。体内和体外实验均证明了NRh-G-NPs对**治疗的特异性和有效性,在荧光成像引导的光热治疗中具有巨大的潜力。
参考文献
Fangyuan Zhou, Shikui Yang, Chao Zhao, Wangwang Liu, Xufeng Yao, Hui Yu, Xiaolian Sun*, Yi Liu*, Theranostics, 2021, 11, 7045-7056. DOI: 10.7150/thno.60586. https://www.thno.org/v11p7045.html.
产品提供
| 序号 | 新闻标题 | 浏览次数 | 作者 | 发布时间 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 837 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 862 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基与NHS活性酯反应PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1639 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid叠氮八聚乙二醇羧酸 | 774 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 877 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮缩硫醇-聚磷酸酯 PPE-TK | 936 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙键响应性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 913 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在线咨询
在线咨询








 库存查询
库存查询