- 029-86354885
- 18392009562
内容提要
创伤性脑损伤(TBI)是一种发病率高、死亡率高的急性病。目前早期诊断和对病理过程的实时反馈的方法仍然有限。本文提出了一种第二近红外窗口(NIR-II)的靶向可激活荧光纳米探针(v&A@Ag2S)用于TBI的体内光学成像。V&A@Ag2S的荧光由于能量从Ag2S转移到A1094发色团而被关闭。经静脉注射后,V&A@Ag2S基于VCAM1介导的吞噬作用在TBI的炎症血管内皮中迅速积累,由于A1094被TBI的前驱生物标志物过氧亚硝酸盐(ONOO-))漂白,纳米探针实现了Ag2S量子点NIR-II荧光的快速恢复。该纳米探针对ONOO-具有高特异性、快速响应和高灵敏度,为TBI的体内早期实时评估提供了方便的方法。
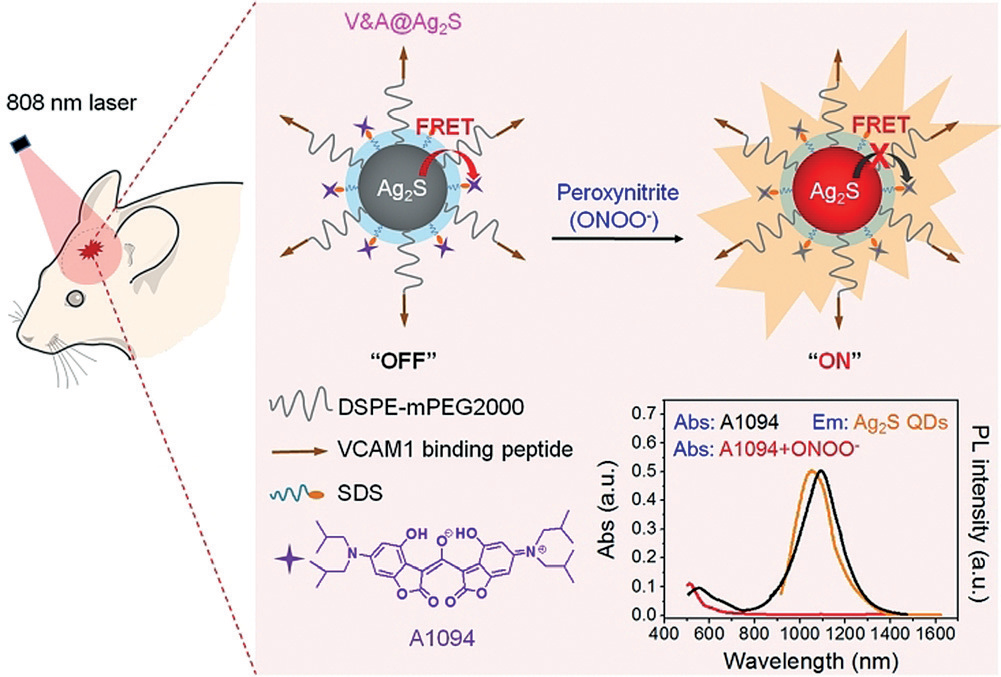
前言
创伤性脑损伤(TBI)是人类死亡和残疾的一个重要原因。由于创伤性脑损伤的继发性损伤包括炎症、血脑屏障(BBB)破坏、氧化应激、缺氧和缺血等往往是隐形的,因此实现早期实时诊断和有效干预的方法是成功的TBI治疗的关键。计算机断层扫描(CT)和磁共振成像(MRI)是经常用于TBI诊断的体内成像方式,它们主要检测器官的解剖和功能变化,而在检测TBI基础的早期分子水平变化方面用处不大。因此,迫切需要开发高灵敏度的新方法来实现TBI的原位早期实时诊断和治疗评估。荧光成像技术由于其快速反馈、多信号采集、高灵敏度和不存在电离辐射等固有特性,是实时监测生物体疾病发生和发展的特别有利的方法。第二近红外窗口(NIR-II, 1000-1700 nm)的荧光成像吸引了很多关注,因为它具有无与伦比的组织穿透(几厘米)和空间分辨率(约10毫米),是下一代活体成像技术的首选。早期生物标志物的识别和相关分子探针的开发对TBI的早期诊断至关重要。脑血管系统的过氧亚硝酸盐(ONOO-)有助于显著的创伤性脑损伤进展,使其成为创伤性脑损伤的前驱生物标志物。作者报道了一种新型靶向可激活NIR-II纳米探针(V&A@Ag2S)的设计和合成,用于TBI早期生物标志物的实时体内成像。由于A1094的吸收光谱与Ag2S量子点的发射光谱有很大的重叠,在没有ONOO-的情况下,有效能量从Ag2S量子点转移到A1094的情况下,V&A@Ag2S仍然处于“关”状态;ONOO-存在时,A1094被氧化,1094 nm处的吸收峰消失,因此,Ag2S量子点被“打开”,并在1050 nm处诱导荧光信号显著上升。与VCAM1结合的肽结合使纳米探针能够在TBI区域对表达VCAM1的炎症内皮具有高的靶向能力。这种新型靶向可激活NIR-II纳米探针具有未来临床应用的潜力。
结果与讨论
V&A@Ag2S的透射电子显微镜(TEM)显示所制备的V&A@Ag2S纳米探针的高均匀性,平均核心尺寸为Ag2S量子点直径约3.3 nm。动态光散射(DLS)测量表明,V&A@Ag2S纳米探针在水溶液中的水动力直径(HD)为39.4 nm。在VHPK阳离子肽表面附着后,纳米探针的zeta电位由@52.5 mV提高到@2.8 mV。Ag2S量子点具有典型的宽带吸收和尖锐的NIR-II发射光谱。与A1094偶联后,在1094 nm处出现了一个强烈的吸收峰,与Ag2S量子点的发射有很大的重叠,保证了Ag2S量子点与A1094之间的高效荧光共振能量转移(FRET)。作者通过记录其对各种ROS/RNS的反应来检测探针的特异性。除了ONOO-/ClO-,没有其他分析物激活V&A@Ag2S的荧光,表明V&A@Ag2S对ONOO@具有很强的特异性(图1a,b)。在V&A@Ag2S溶液(50 mg×mL-1)中加入不同浓度的ONOO-,V&A@Ag2S在1050 nm处的荧光强度与ONOO-的浓度呈线性关系,表明V&A@Ag2S对ONOO-的定量潜力巨大(图1c,d)。V&A@Ag2S对ONOO-的动态响应在1秒内完成,证明了ONOO-检测这一强大工具对其极短的半衰期的优越性。考虑到Ag2S量子点在化学上是惰性的,作者研究了A1094与各种ROS/RNS/离子之间的相互作用,以确定参与这一过程的主要因素。为了鉴定添加ONOO-后的A1094的氧化产物,采用HPLC-MS对最终产物进行分析。其机理可以归因于A1094与ONOO@的氧化反应,之后共轭结构被破坏,影响了电子转移过程,导致1094 nm处特征A1094吸收峰消失。
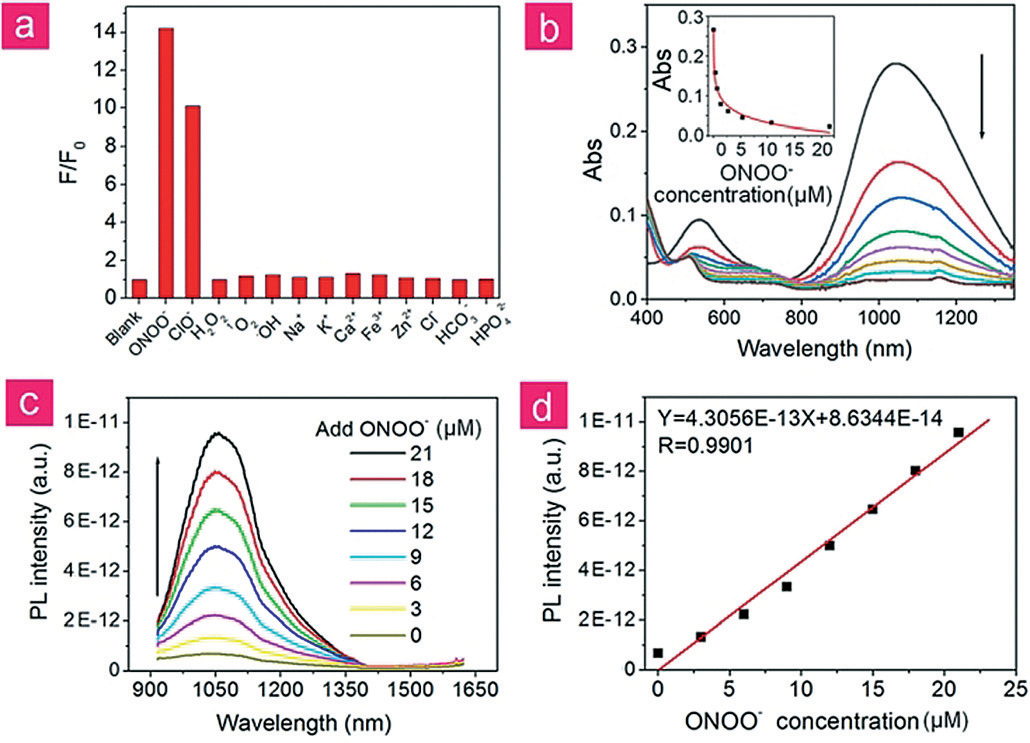
图1。a)不同ROS/RNS分析物和离子加入20 mm时,10 mg×mL-1 V&A@Ag2S的NIR-II荧光强度变化。b) ONOO-逐渐加入A1094的吸收光谱(从0到21 mM)。插图:1094 nm处的吸收强度与ONOO-浓度的函数关系图。c) V&A@Ag2S在水溶液(50mg×mL-1)中的光致发光回收率为ONOO-浓度 (0-21 mm)的函数。d)在1050 nm处的荧光强度与ONOO-浓度的关系图。
由于VCAM1在多种炎症性血管疾病的内皮细胞中表达上调,并且已知VHPK多肽偶联纳米颗粒通过VCAM1介导的内吞被摄取,作者首先确定了V&A@Ag2S是否能够有效内化到炎症性血管细胞中。作者用Cy7.5 (λem = 825 nm)标记,并进一步进行细胞成像处理。人脐静脉内皮细胞(HUVECs)用TNF-a预处理12小时,然后与Cy7.5修饰的V&A@Ag2S孵育1小时,使用荧光显微镜成像。如图2a所示,在TNF-a处理的HUVECs中可以观察到Cy7.5强烈的荧光信号,而在未处理的HUVECs中荧光非常微弱。流式定量Cy7.5的荧光强度进一步证实了这一结果血细胞计数(图2 b)。荧光免疫组化分析显示TNF-a显著增加了VCAM1的表达(图2c),表明V&A@Ag2S可以通过VCAM1依赖的细胞内运输在炎症内皮细胞中实现高效内化。
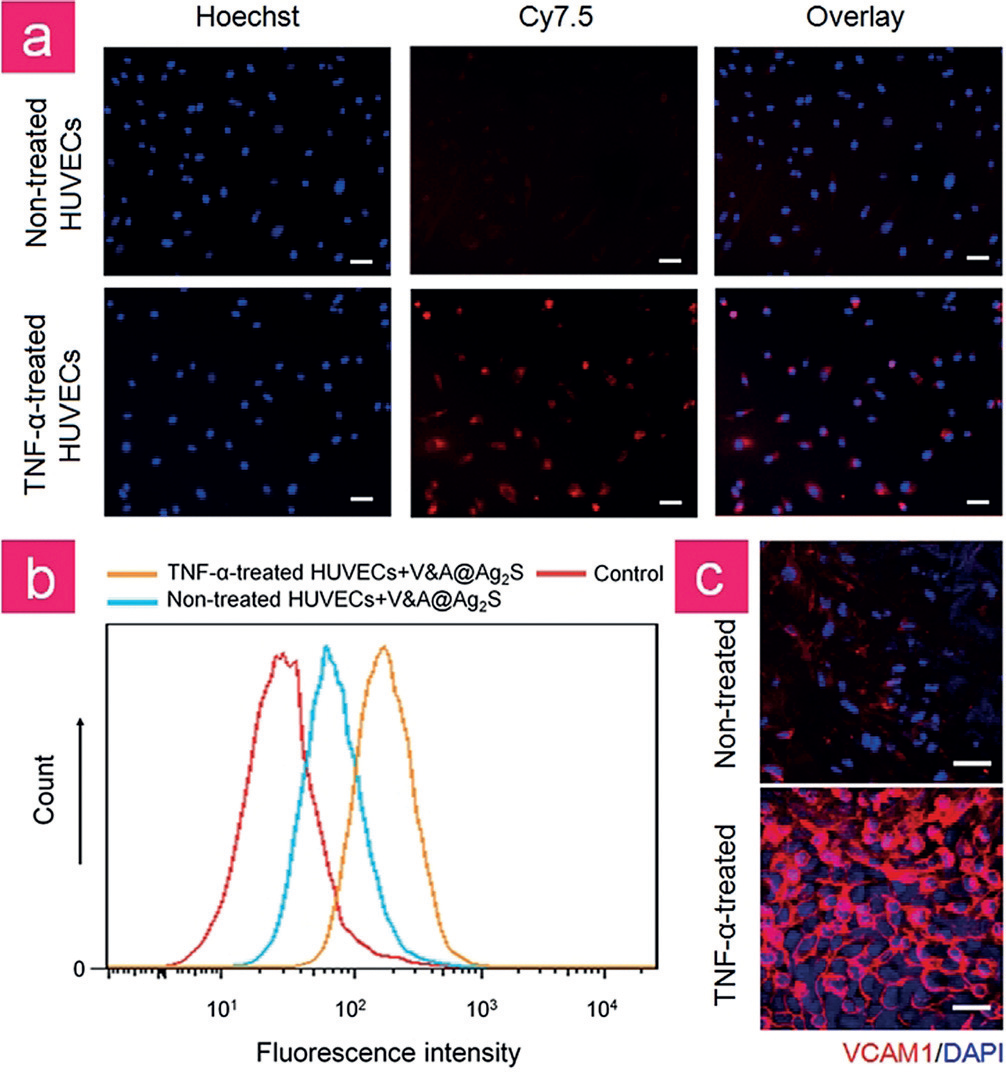
图2。a) 荧光显微镜成像TNF-a处理的HUVECs和未处理的HUVECs与Cy7.5修饰纳米探针在37°C孵育1小时。b)流式细胞术分析Cy7.5修饰纳米探针预孵育的HUVECs。PBS孵育的细胞作为阴性对照。c) HUVECs用TNF-a处理,并进一步用VCAM1抗体染色(红色)。比例尺= 50 mm。
为了进一步揭示V&A@Ag2S的细胞内分布,采用共聚焦激光扫描显微镜(CLSM)进行荧光共定位成像。TNF-a预处理HUVECs10 mg×mL-11V&A@Ag2S 1 h,再用两种典型细胞器探针LysoTracker (577/590 nm,溶酶体探针)和MitoTracker (490/510 nm,线粒体探针),从而达到特定的成像的溶酶体和活细胞的线粒体。借助Cy7.5的荧光信号,V&A@Ag2S的胞内定位可以通过共焦成像很容易探测(图3a,c)。Cy7.5和LysoTracker几乎完全重叠(图3b),表明V&A@Ag2S主要位于VCAM1介导的内吞后的溶酶体中。
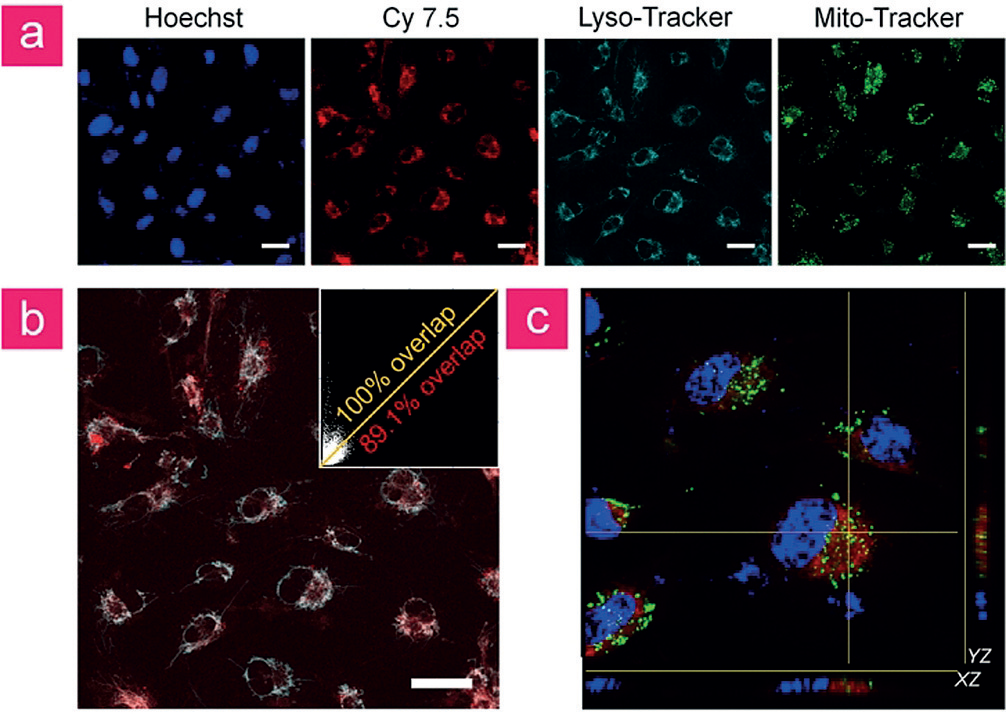
图3。a) 将细胞与Cy7.5修饰的V&A@Ag2S在378C孵育1小时,然后进一步与LysoTracker、MitoTracker和Hoechst孵育。b) Cy7.5和LysoTracker的共定位图像显示这两个通道之间存在大量重叠。c) 炎症内皮细胞三维荧光图像。比例尺= 20 mm。
作者进行了研究其用于细胞内监测的可行性ONOO-的产生。为此,我们使用3-morpholinosydnonimine (SIN-1)诱导内皮细胞氧化应激在体内模拟TBI生成ONOO-。HUVECs与TNF-a预孵育,然后与V&A@Ag2S再孵育1 h,然后用或不加SIN-1)刺激。如图4a所示,在没有ONOO-的前体 SIN-1的情况下,用V&A@Ag2S处理的HUVECs中没有检测到NIR-II荧光信号。相反,在SIN-1中,NIR-II荧光在30 min内产生强烈的荧光,表现出与时间相关的NIR-II荧光信号增强(图4b),从而表明纳米探针的荧光恢复速度快,在ONOO 活体中具有优秀的快速实时检测能力。通过标准的抗Annexin V-FITC和PI双染色以及流式细胞术评估了V&A@Ag2S对HUVECs、人骨间充质干细胞(BMSCs)和小鼠成纤维细胞L929细胞的细胞毒性。在V&A@Ag2S浓度为20-100 mg×mL-1的情况下,细胞在孵育24 h后的存活率估计分别大于83%、91%和95%,表明V&A@Ag2S的毒性相对较低。V&A@Ag2S的体内毒性也通过静脉注射V&A@Ag2S后24 h和7 d采集血样进行评估,剂量为2mg×kg-1。血液生化和血液学分析显示,与对照组相比,指标的波动可以忽略不计,表明纳米探针具有较高的生物相容性。
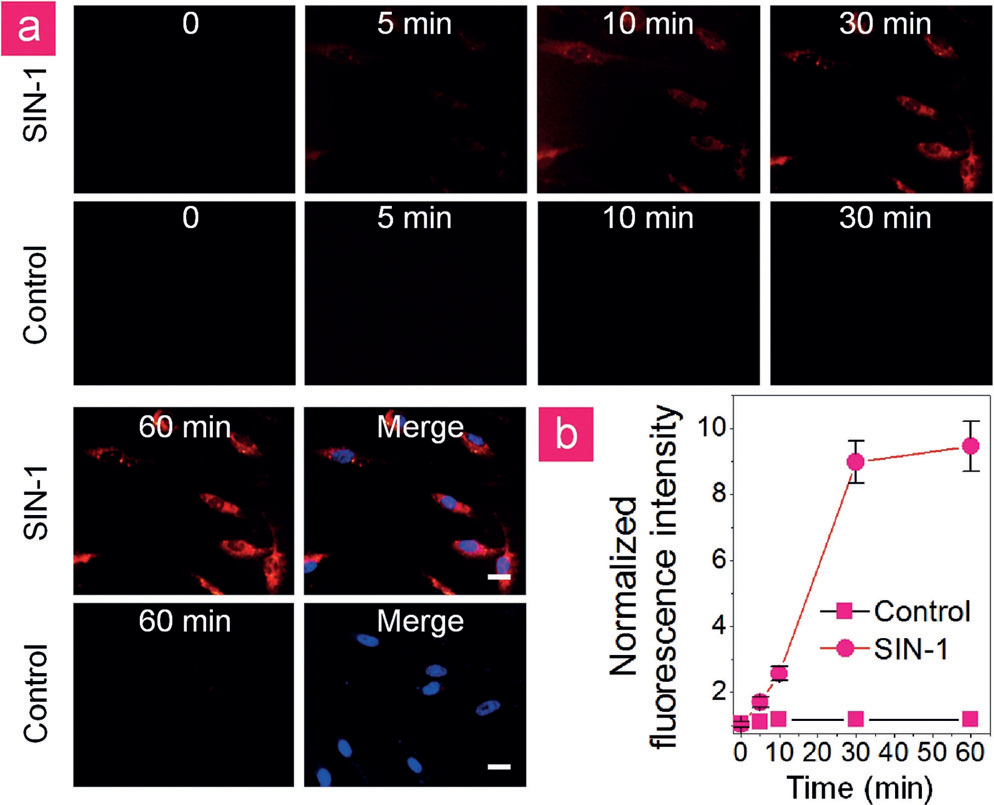
图4。a) 经TNF-a处理的HUVECs与V&A@Ag2S (10 mgmL@1)预孵卵1 h,然后用或不加SIN-1 (0.5 mm)刺激。b)不同处理HUVECs细胞质内NIR-II荧光强度的时间跨度。比例尺= 10mm
采用了创伤性脑损伤小鼠模型,评估了所制备的纳米探针在体内ONOO-检测的可行性。采用对照颅骨钻孔穿刺法在胸苷激酶小鼠右侧头部诱导TBI,以V@Ag2S (VCAM1偶联的Ag2S QDs,“始终on”探针)和V&A@Ag2S (A1094偶联的Ag2S QDs,非靶向探针)作为对照。静脉注射永久开启的探针V&A@Ag2S,开始时荧光信号在整个脑区广泛分布(图5)。在捕获NIR-II荧光图像的时间跨度内,荧光信号逐渐衰减,虽然由于极高的背景噪声导致低信噪比,很难将TBI区域与正常脑组织区分开来。可激活的NIR-II探针V&A@Ag2S允许TBI快速特异的荧光成像。如图5所示,在注射纳米探针后,TBI小鼠右脑半球立即出现了NIR-II荧光信号,其他区域均未发现荧光。由于缺乏背景噪声,在注射后10分钟内,优越的靶组织与正常组织的信号比(SNR >10.2)实现了体内快速诊断。随后,病变部位荧光信号稳定增强,表明V&A@Ag2S实现了对内源性RNS的高灵敏度、实时原位检测。相比之下,在非靶向A@Ag2S探针组和动物对照组(健康小鼠)的大脑半球均未观察到显著信号。结果表明,基于这种靶向激活的NIR-II成像策略,ONOO-动态过程很容易在活鼠中检测到。
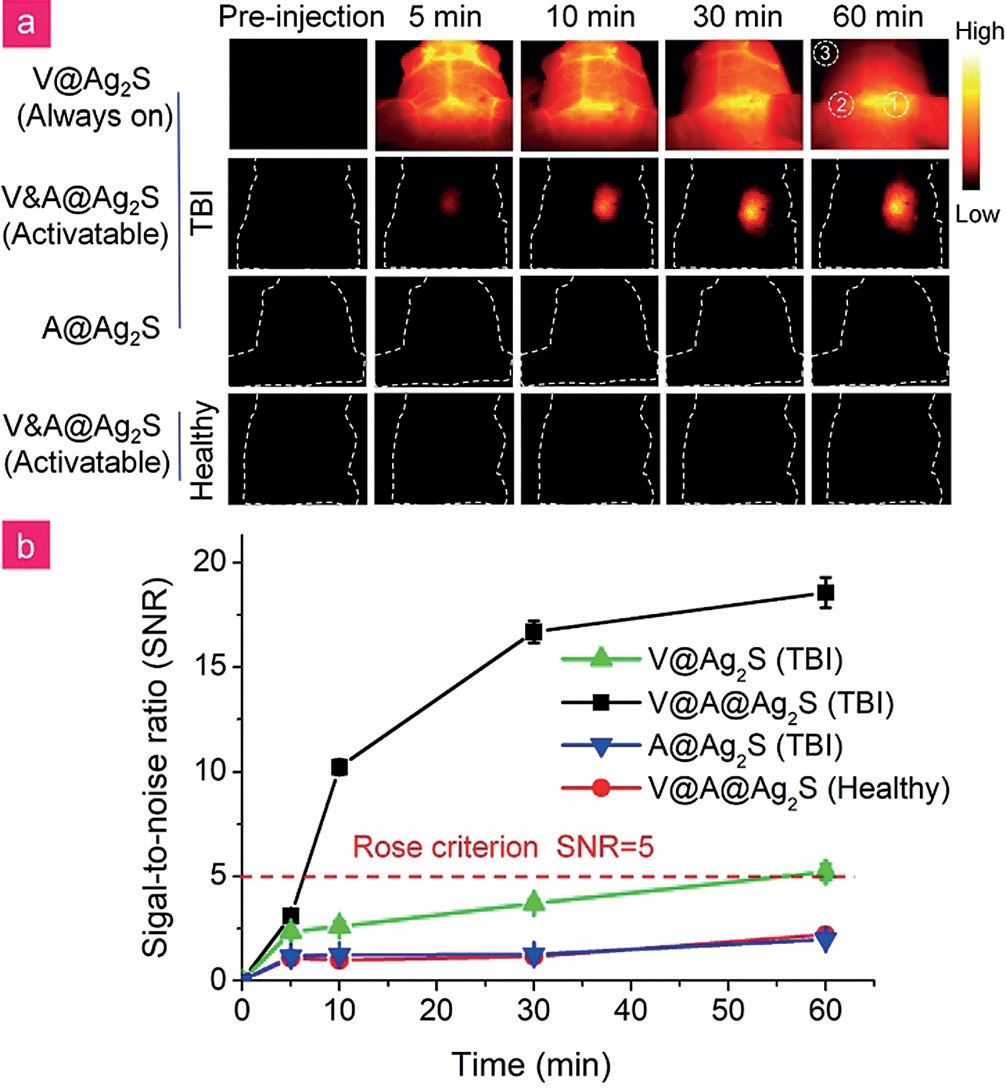
图5。a)注射V@Ag2S、V&A@Ag2S、A@Ag2S后不同时间点NIR-II荧光在脑血管损伤和健康小鼠中的时间跨度。b)不同处理后小鼠NIR-II荧光成像测定的时间依赖性信噪比(SNR)变化。
结论
作者开发了一种可激活的靶向NIR-II荧光纳米探针,用于快速、灵敏地检测ONOO-。A1094, ONOO—响应染料的吸光度NIR-II地区,成功引入NIR-II表面量子点Ag2S,实现较低的检出限。利用NIR-II Ag2S量子点的独特光学特性,证明了这种纳米探针用于TBI模型体内RNS检测的可行性。该NIR-II生物传感系统的成功开发标志着在体内荧光诊断方面迈出了重要的一步。我们设想,在体内转换传感和成像策略在第二近红外窗口将打开巨大的潜力荧光成像的临床实践。
参考文献
Chunyan Li,* Wanfei Li+, Huanhuan Liu, Yejun Zhang, Guangcun Chen, Zijing Li,* Qiangbin Wang*, An Activatable NIR-II Nanoprobe for In Vivo Early Real-Time Diagnosis of Traumatic Brain Injury, Angew. Chem. Int. Ed. 2020, 59, 247 –252. DOI:10.1002/anie.201911803.
https://onlinelibrary.wiley.com/doi/10.1002/anie.201911803
产品提供
| 序号 | 新闻标题 | 浏览次数 | 作者 | 发布时间 |
|---|---|---|---|---|
| 1 | 抗氧化小分子70831-56-0,菊苣酸Cichoric Acid,6537-80-0的制备过程 | 1033 | 瑞禧生物 | 2023-03-30 |
| 2 | 活性氧ROS小分子Dapsone,cas:80-08-0,氨苯砜的制备过程-瑞禧科研 | 935 | 瑞禧生物 | 2023-03-30 |
| 3 | HBPS-N3,Azide-PEG-HBPS,叠氮化超支化聚苯乙烯高分子聚合物的制备过程 | 1079 | 瑞禧生物 | 2023-03-17 |
| 4 | l-PS-PhN3,Azide叠氮Azido偶联线性聚苯乙烯双链的制备过程 | 962 | 瑞禧生物 | 2023-03-17 |
| 5 | N3-PS-N3,Azido-PS-Azido/Azide,双叠氮官能团修饰聚苯乙烯的制备方法 | 915 | 瑞禧生物 | 2023-03-17 |
| 6 | PS-N3,Azido-PS,叠氮Azide修饰聚苯乙烯/高分子聚合物的制备过程 | 1122 | 瑞禧生物 | 2023-03-17 |
| 7 | Azido-PEG2-t-Butylester/1271728-79-0,叠氮N3/ZAD修饰叔丁酯化合物的制备方法 | 949 | 瑞禧生物 | 2023-03-14 |


 400-115-0588
400-115-0588 在线咨询
在线咨询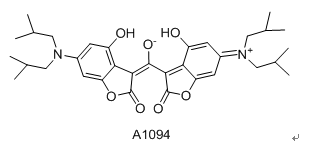








 库存查询
库存查询