产品分类
快速订购
31952518
- 029-86354885
- 18392009562
sales@xarxbio.com
首页 > 资料专栏

内容提要
本文构建了一个负载羰基铁簇合物的纳米平台(FeCORM NPs),通过化学动力学治疗(CDT)和免疫原性细胞死亡(ICD)诱导的免疫治疗,对黑色素瘤的肺转移表现出优异的疗效。羰基铁簇合物纳米粒子可由谷胱甘肽(GSH)和过氧化氢(H2O2)引发,通过配体交换和氧化还原破坏途径释放CO并生成亚铁盐,释放的CO导致线粒体损伤,而生成的亚铁盐通过Fenton反应导致氧化应激。另一方面,纳米材料诱导基于ICD的免疫治疗,与CDT共同作用,通过小鼠模型显示出极好的抗黑色素瘤肺转移效果。这项工作构建一个简单稳定的纳米平台,利用**中相对较高水平的GSH和H2O2来启动治疗效果,从而使纳米平台能够区分正常细胞和**细胞。该系统不仅在治疗黑色素瘤的肺转移,而且在抑制其他类型的**转移。前言
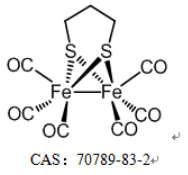
恶性黑色素瘤(MM)是一种来源于皮肤黑色素细胞的恶性**,很容易扩散到淋巴结、肝、肺、脑和其他器官。肺是其最常见的远处转移靶点。一旦发生转移,其预后和治疗都会很困难。为了提高黑色素瘤肺转移的生存率,需要更有效、更特异的治疗策略,尽管这些策略具有挑战性。免疫原性细胞死亡(ICD)越来越被认为是一种细胞死亡途径,已成为癌症免疫治疗(IMT)的策略之一。基于外部刺激的疗法,如光动力疗法(PDT)、放射疗法(RT)、光热疗法(PTT)。然而,基于**微环境(TME)等内部刺激诱导ICD具有挑战性。作为一种微创治疗策略,化学动力学疗法(CDT)是一种通过芬顿反应产生高度细胞毒性活性氧(ROS)(例如:·OH、1O2和O2·–)的有前景的TME反应性治疗。癌细胞中高于毒性阈值的ROS水平可能压倒抗氧化系统,并启动ICD以调节死亡癌细胞的免疫原性,这是一种更好的协同治疗策略。因此,需要设计单一成分的平台,使用内源性刺激诱导和增强ICD,而癌症IMT的疗效不会受到影响。在此,我们报告了一种新的纳米平台(FeCORM NPs),即负载有二铁六羰基化合物(FeCORM)的纳米颗粒,该纳米颗粒不含额外成分且对TME具有响应性。在组装过程中,采用聚苯乙烯-马来酸共聚物-聚(乙二醇)-聚(乙二醇)(PSMA-PEG)作为载体,通过载体与铁羰基化合物之间的疏水作用来负载FeCORM NPs,从而形成纳米颗粒。FeCORM NPs可与过氧化氢(H2O2)和谷胱甘肽(GSH)反应生成活性氧(ROS)并在癌细胞中释放一氧化碳(CO),从而诱导CDT和ICD诱导IMT,在体内对黑色素瘤的肺转移显示出良好的效果。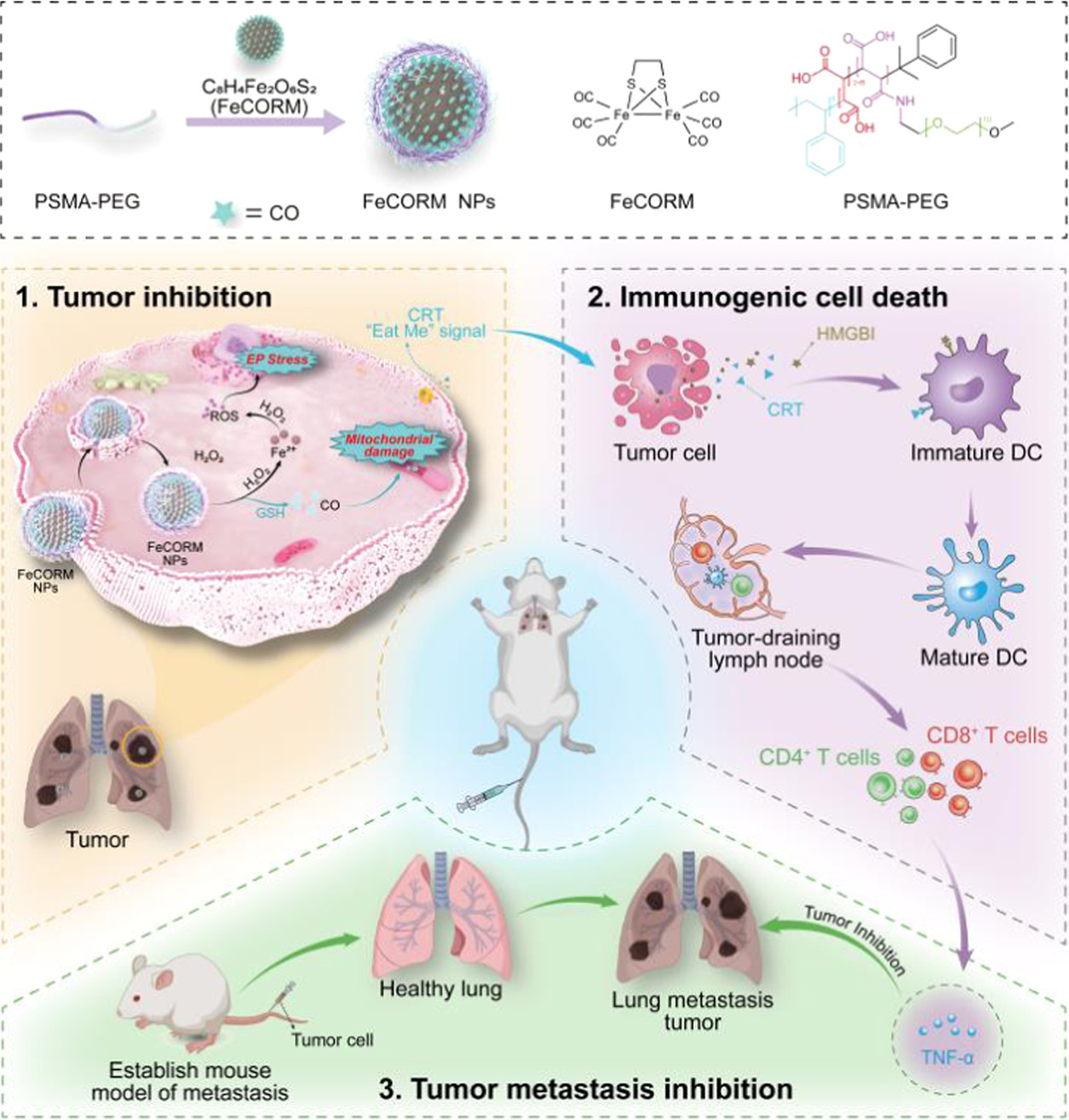
FeCORM 纳米粒子及其治疗效果形成的示意图。
结果与讨论
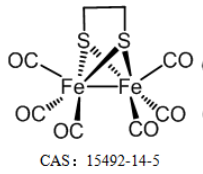
FeCORM NPs通过铁羰基络合物(FeCORM,C8H4Fe2O6S2或[Fe2(μ-SCH2)2(CO)6],和聚苯乙烯-马来酸钴-聚乙二醇-聚乙二醇(PSMA-PEG)之间的疏水-疏水相互作用进行自组装。TEM图像显示,FeCORM NPs呈球形,尺寸为∼60纳米。通过动态光散射测量FeCORM NPs的平均流体动力学直径为65±2 nm。纳米颗粒表面带负电荷,测量电位为−33.2±3.4 mV。带负电的表面确保了胶体系统在水中的高稳定性。通过监测长达14天的流体动力学直径,其在盐水和水中的长期稳定性得以保持。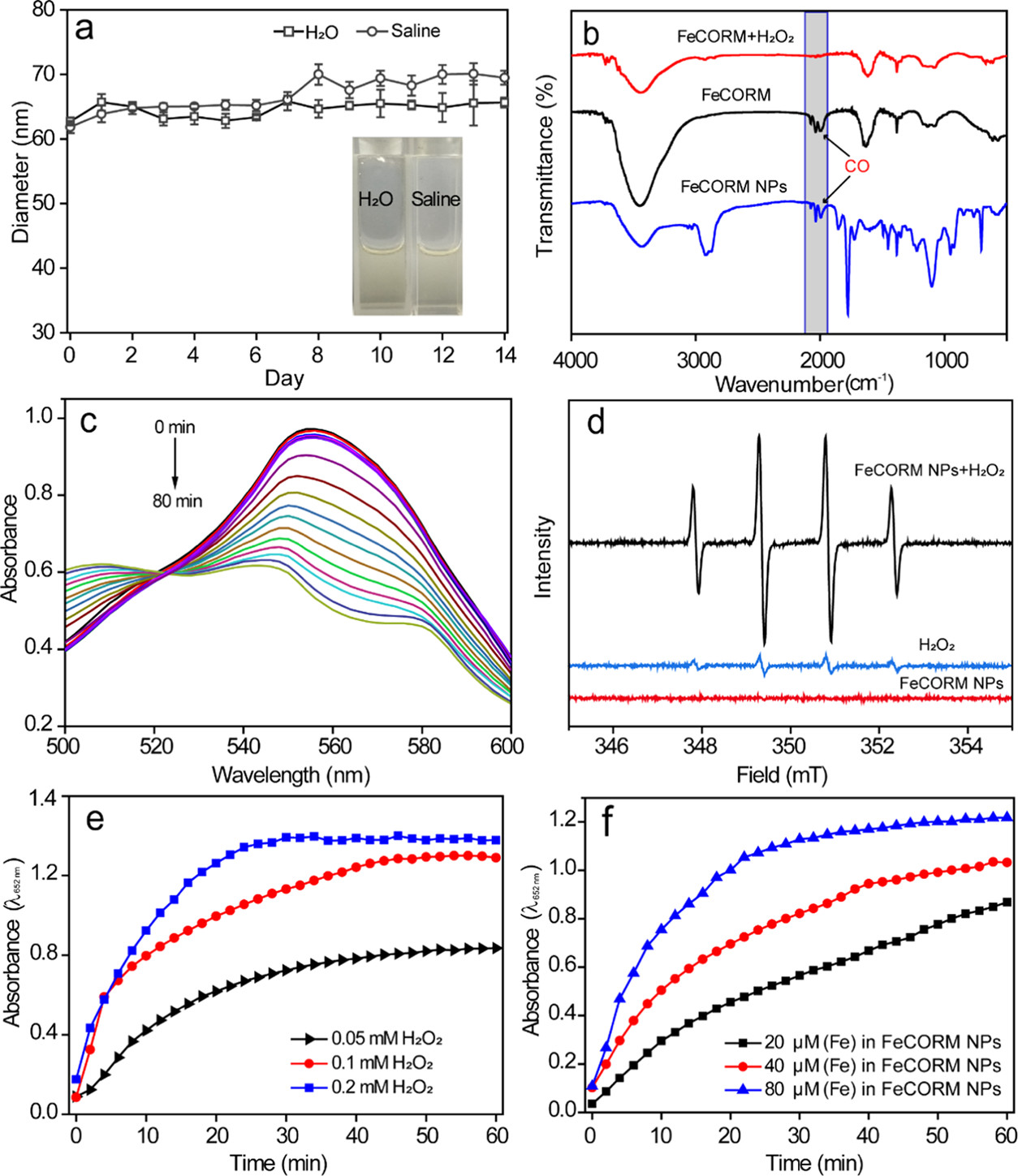
在目前的系统中,GSH确实被用于促进FeCORM NPs的CO释放,这是使用以肌红蛋白(Mb)为探针的紫外-可见光谱法进行监测的。在540和577 nm处出现了两条新的吸收带,表明由于FeCORM NPs释放CO而形成MbCO。在存在10 mM GSH的情况下,纳米颗粒的CO释放在50 min内完成。除了TME中相对较高浓度的GSH外,还存在H2O2,每104个细胞每小时的H2O2浓度高达0.5 nmol。H2O2的存在确实触发了CO释放。在存在H2O2的情况下,纳米颗粒的尺寸在24小时内变大,这可能是由于释放CO导致纳米颗粒结构的变化。。这种H2O2响应机制不像GSH触发的CO释放那样通过配体交换,而是通过金属中心的氧化。XPS数据证实了FeCORM NPs和H2O2混合物中存在Fe(II)。考虑到CO释放过程中产生的Fe(II)物种以及H2O2的存在,可能会发生Fenton反应。我们使用3,3′,5,5′-四甲基联苯胺(TMB)作为探针来检测其Fenton活性。FeCORM NPs和H2O2在pH 5.2下的混合物以及5,5-二甲基-1-吡咯啉氧化物(DMPO)作为自由基捕获剂,以1:2:2:1的特征比产生电子自旋共振(ESR)信号,这表明捕获的自由基是羟基自由基(•OH)。•OH的生成取决于FeCORM NPs和H2O2的浓度以及反应时间。这些结果表明,FeCORM NPs在释放CO时对GSH和H2O2都有反应。H2O2引发的CO释放也伴随着通过Fenton反应生成•OH,自由基可能在CDT中具有潜在用途。
为了评价FeCORM-NPs在体外的治疗效果,我们使用了以下两种细胞系:癌细胞(B16-F10)和正常细胞(HUVEC)。通过MTT试验获得的细胞存活率,在B16-F10和HUVEC的IC50值分别为45.4和72.6μM的情况下,纳米平台在孵育24小时后在癌细胞和正常细胞之间显示出一定程度的分化。为了确定过氧化氢和谷胱甘肽在体外是否都能诱导CO释放,并随后产生ROS,从而损伤所检测的B10-F10细胞,分别使用L-丁硫氨酸-亚砜肟(L-BSO)和过氧化氢酶(CAT)抑制细胞中的GSH和H2O2,然后定量分析B16-F10细胞的存活率。所有细胞用Annexinv-FITC/PI凋亡试剂盒标记,流式细胞仪分析。L-BSO+CAT+FeCORM NPs组的细胞存活率高达95.6%,而仅与FeCORM NPs孵育的细胞存活率为31.5%。无论是单用L-BSO还是单用CAT,存活率都有显著提高,分别为88.9%和67.6%,这是由于CAT和L-BSO抑制H2O2和GSH所致。这些数据表明,细胞内H2O2和GSH是导致细胞活力低下的主要因素。GSH和H2O2都引发了铁羰基化合物的分解,在此期间,Fe(II)和H2O2共存将通过Fenton反应途径生成ROS,细胞死亡可以合理地归因于ROS自由基和靶向线粒体释放的CO。
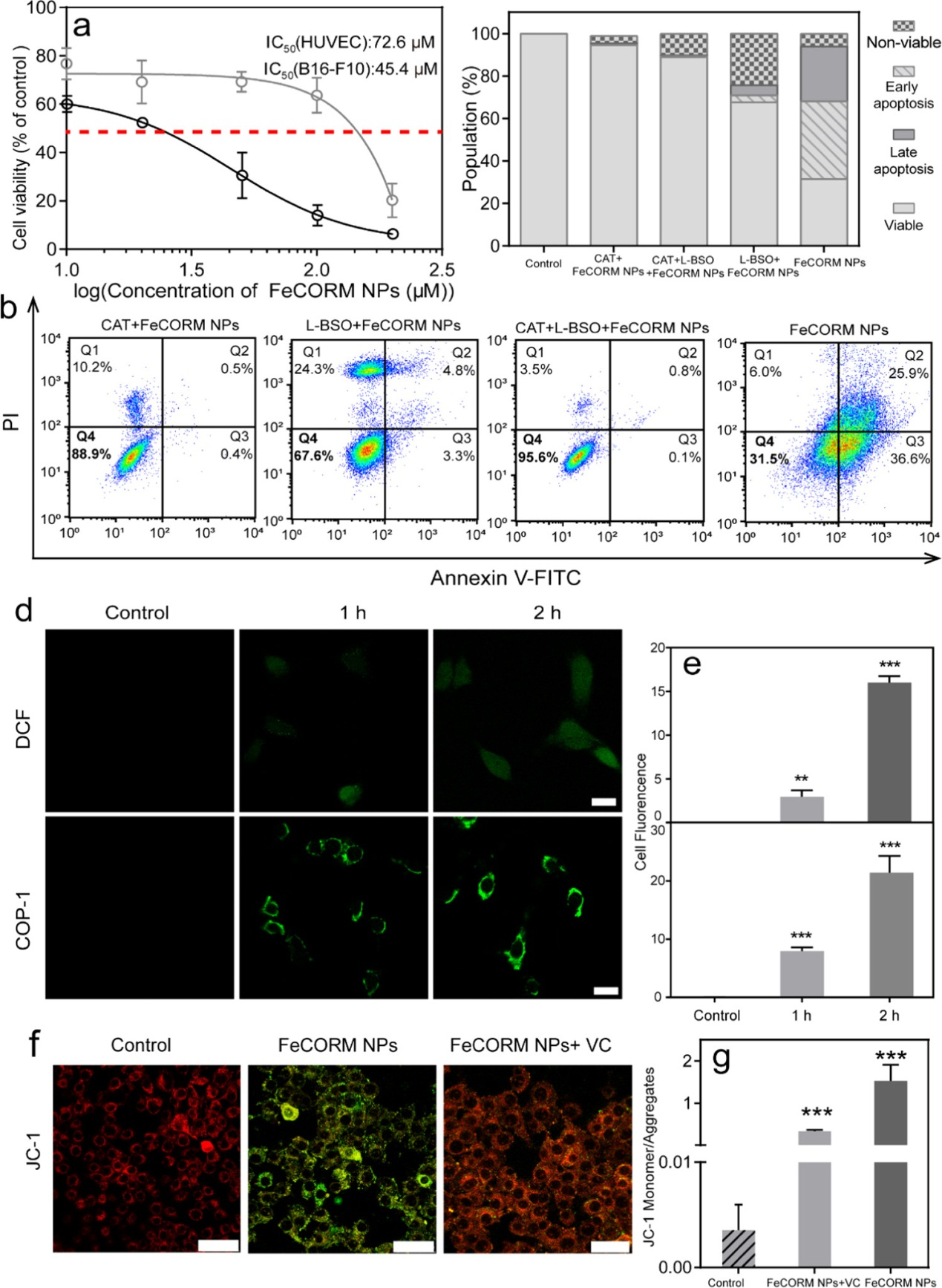
共焦激光扫描显微镜(CLSM)和流式细胞术检测细胞内ROS和CO。使用ROS检测试剂盒(2′,7′-二氯荧光素,DCF探针)和CO探针(COP-1)检测存在FeCORM NPs时产生的细胞内ROS和CO。如荧光强度所示,由FeCORM NPs产生的ROS和CO的细胞内数量随着培养时间的延长而增加。在延长培养时间后,流式细胞术的结果也观察到相同的荧光强度变化趋势。线粒体膜电位探针JC-1被用于评估FeCORM NPs诱导的细胞线粒体损伤。对照组细胞线粒体中的JC-1呈聚合物形式,显示明亮的红色荧光。当存在FeCORM NPs时,由于B16-F10细胞的线粒体膜电位降低,JC-1不能作为聚合物存在于线粒体基质中。因此,线粒体中的红色荧光强度显著减弱,而细胞质中的绿色荧光强度显著增强,这表明线粒体受到严重损伤。通过添加ROS清除剂(VC)来抑制细胞内的ROS水平,从而大大恢复了明亮的红色荧光,表明细胞线粒体损伤显著减少,从而进一步证明了由于存在FeCORM NPs而导致的细胞内ROS及其对线粒体的损伤。对照组、FeCORM NPs组和FeCORM NPs+VC组的绿色和红色荧光强度比分别为0.004、1.5和0.3,定量显示了纳米平台造成的线粒体损伤。
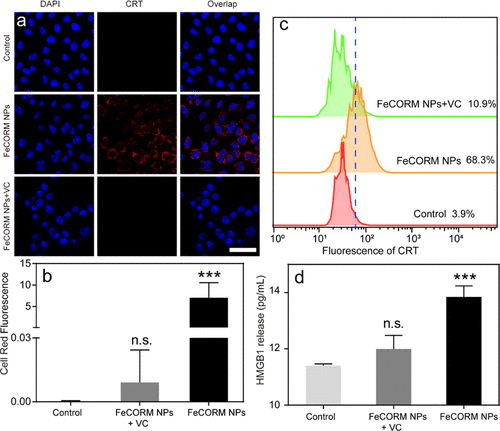
为了研究FeCORM NPs引发的ICD,评估了经FeCORM NPs处理24小时的B16-F10细胞中CRT暴露水平和HMGB1释放。CLSM和流式细胞术用于检测细胞表面CRT暴露。在FeCORM NPs处理组中观察到代表细胞表面CRT的鲜红色荧光,而当添加ROS清除剂(VC)时,红色荧光消失,表明癌细胞表面CRT表达受到抑制。结果有力地证明了活性氧诱导的CRT细胞表面易位。流式细胞术也获得了相同的结果。此外,通过酶联免疫吸附试验(ELISA)分析HMGB1的释放。与对照组和FeCORM NPs+VC组相比,FeCORM NP组显著提高了B16-F10细胞HMGB1的释放。因此,FeCORM NP介导的CDT可以在B16-F10细胞中诱导ICD。
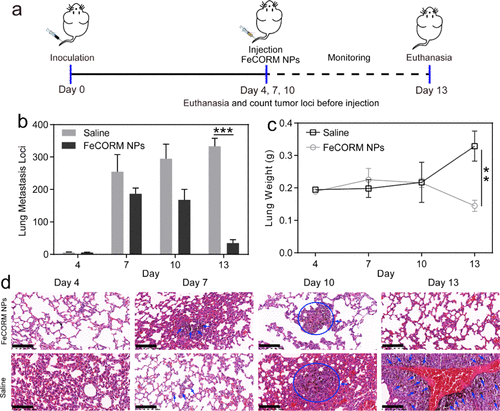
我们进一步评估了FeCORM NPs的体内性能。通过静脉注射5×105 B16-F10黑色素瘤细胞在免疫活性BALB/c小鼠中构建黑色素瘤肺转移模型。第4天,通过尾静脉向小鼠注射FeCORM NPs悬浮液。每三天注射一次,对照组同样注射生理盐水。在第4天、第7天、第10天和第13天,在下一次注射之前移除荷瘤小鼠的肺,然后计算肺转移位点,并在对小鼠实施安乐死后拍摄照片。第4天,肺转移未完全形成,因为对照组和使用FeCORM NPs的治疗组之间没有显著差异。第7天,治疗组的肺转移位点数(186.7±18.0)比对照组(254.7±52.9)低约30%。在接下来的三天内,治疗组(168.3±31.7)和对照组(294.7±45.1)均未观察到显著变化。然而,进一步的治疗显示出显著的差异,因为在第13天,治疗组的肺转移位点数量迅速下降至34.7±10.5,而对照组的肺转移位点数量(333.3±24.5)比FeCORM NPs组高10倍。结果表明,FeCORM NPs显著抑制黑色素瘤肺转移的生长。小鼠平均肺重量的变化也证明了治疗的效果。与第4天的平均肺重量相比,治疗组的平均肺重量下降了约25%,而由于黑色素瘤肺转移的增长,对照组的平均肺重量在第13天增加了50%以上。此外,各组肺部的苏木精和曙红(H&E)以及HMGB1染色图像。用蓝色箭头或圆圈突出显示的区域代表肺转移区域。这些结果与肺转移位点的计算结果一致。所有这些结果都表明FeCORM NPs可以抑制肺转移。对肺转移的神奇抑制可能不仅归因于CDT,还与小鼠免疫系统的激活有关。
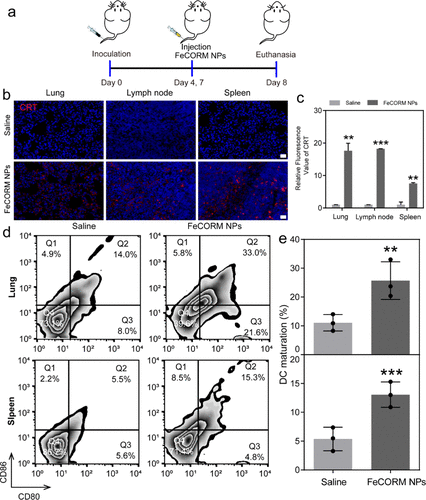
如上所述,我们认为纳米平台对黑色素瘤肺转移的疗效可能部分来自于激活小鼠的免疫反应。在第8天对荷瘤小鼠实施安乐死后,收集荷瘤小鼠的肺、引流淋巴结和脾脏。通过对肺、引流淋巴结和脾脏的CRT染色检查CRT暴露。细胞核区域发出蓝色荧光,细胞膜上的CRT曝光呈红色。使用ImageJ计算CRT的平均荧光强度,FeCORM NPs组在肺、引流淋巴结和脾脏中的红色荧光强度比分别为17.6±2.3、18.2±0.04和7.6±0.2。这些结果表明,由于在**区域有效积累FeCORM NPs,导致CRT暴露显著,从而诱发ICD。众所周知,CRT暴露(DAMP之一)是DC成熟的关键刺激。通过使用流式细胞术分析第8天从荷瘤小鼠肺和脾脏获得的DC成熟的两个生物标记物(CD80和CD86)来评估DC成熟。与对照组相比,FeCORM NPs治疗组的DC成熟率在肺和脾脏都增加了一倍以上。这些结果坚定地证明了FeCORM NPs介导的CDT通过ICD诱导抗**免疫反应的效力,以及CRT暴露的增加和DC在体内的成熟,这使得纳米平台具有抗黑色素瘤肺转移的强大功效。
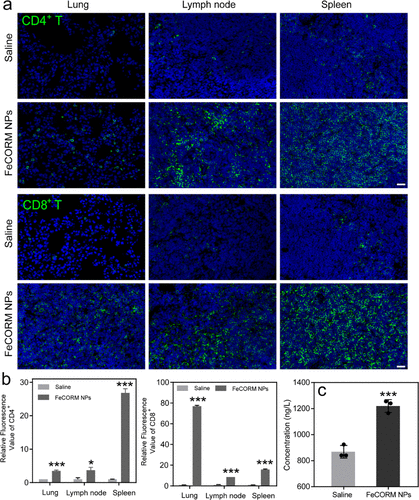
活化的DC可进一步促进**组织周围T淋巴细胞的募集和分化。用免疫荧光染色法对患有黑色素瘤肺转移的小鼠的CD8 T和CD4 T细胞水平进行了研究。绿色荧光强度形成鲜明对比,表明对照组和FeCORM NPs治疗组之间的CD4和CD8 T细胞水平。两种类型T细胞的定量分析表明,与生理盐水组相比,治疗组的所有三种组织都显著增加,尽管这些组织中的分化增加。与对照组相比,肺中的细胞毒性CD8 T细胞几乎增加了80倍,而脾脏中的CD4 T细胞几乎增加了30倍;在使用FeCORM NPs治疗后,三种组织中观察到最显著的增加。对于其余的组织,两个T细胞从几倍增加到大约30倍。这些结果表明,纳米材料引发了小鼠的整体免疫反应,以产生强大的抗**T细胞。ICD诱导的这些免疫反应进一步刺激了适应性免疫反应,包括免疫促进细胞因子(如TNF-α)的产生,用ELISA评估**中的TNF-α水平,FeCORM NPs组(1220.2±40.2 ng/L)显著高于生理盐水组(754.1±165.9 ng/L)。增加的细胞因子进一步增强了纳米材料抗**细胞的功效。结果很好地证明了ICD是细胞死亡的途径之一,因此证明了纳米平台FeCORM NPs对黑色素瘤肺转移的活性。
结论
我们构建了一种新型TME反应性纳米平台FeCORM NPs,用于包括CO、CDT和ICD触发的IMT在内的联合治疗。在TME中,GSH和H2O2引发了纳米平台FeCORM NPs的CO释放,在此过程中还生成了亚铁盐,可引发一系列细胞内活性,协同抑制黑色素瘤的肺转移。FeCORM NPs介导的CDT诱导基于ICD的抗**免疫反应,**细胞DAMP释放增加,成熟DC比例增加,激活了**中的T淋巴细胞。体外和体内研究均证实了其对**的有效作用。参考文献
Tumor Microenvironment-Activated Nanoparticles Loaded with an Iron-Carbonyl Complex for Chemodynamic Immunotherapy of Lung Metastasis of Melanoma In Vivo, Tianli Zhai, Wei Zhong, Yucong Gao, Han Zhou, Zhiguo Zhou, Xiaoming Liu*, Shiping Yang, and Hong Yang*, Angew. ACS Appl. Mater. Interfaces 2021, 13, 33, 39100–39111
产品提供
| 序号 | 新闻标题 | 浏览次数 | 作者 | 发布时间 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 837 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 862 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基与NHS活性酯反应PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1639 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid叠氮八聚乙二醇羧酸 | 774 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 877 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮缩硫醇-聚磷酸酯 PPE-TK | 936 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙键响应性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 913 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在线咨询
在线咨询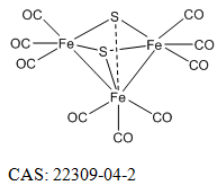








 库存查询
库存查询