- 029-86354885
- 18392009562
本文设计并合成了多功能硅(IV)酞菁衍生物PcAF,PcAF在水溶液中通过自发组装形成均匀稳定的纳米球(NanoPcAF)。与传统酞菁高度依赖于O2的II型光反应不同,NanoPcAF表现出高效的I型光反应,产生丰富的超氧自由基(O2•−)和显著的振动松弛,从而诱导相对较高的光热转换效率。在低氧条件下,NanoPcAF产生的O2•−是亚甲基蓝(MB)的3.4倍。NanoPcAF的光热转换效率比吲哚菁绿(ICG)高2.4倍。系统给药后,NanoPcAF显示了极好的**聚集,**/肝脏比率高达5。在临床前模型中,光治疗过程中和之后没有观察到明显的毒性。
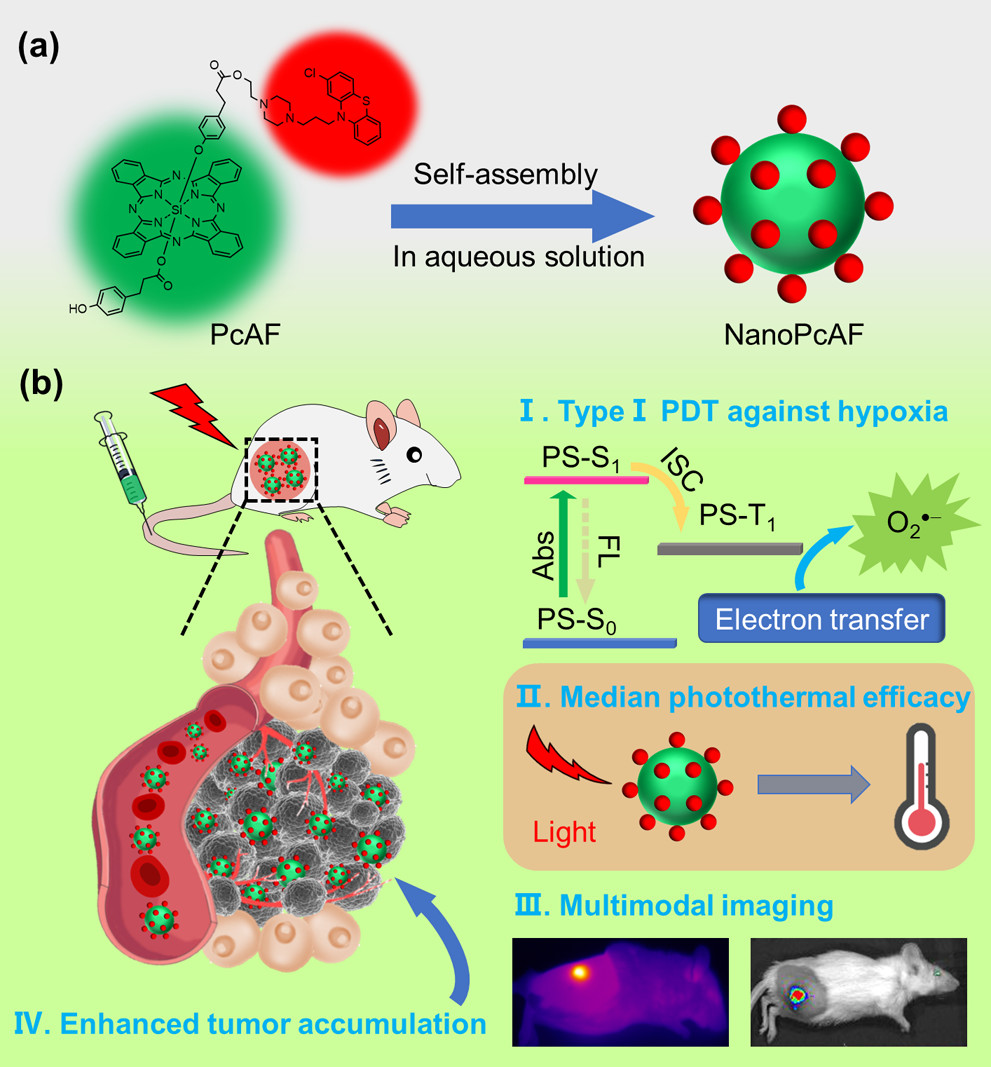
为了更好地理解PcAF的自组装行为和组装机理,我们采用不含吩噻嗪的硅(IV)酞菁衍生物(PcA)和含两个吩噻嗪的硅(IV)酞菁(PcBF)研究它们的聚集现象。PcA在水溶液中自组装形成100 nm均匀的纳米颗粒分布(NanoPcA)。相对于NanoPcA的良好稳定性,PcA在时效超过1 h后出现了严重的聚集现象,尺寸约为1200 nm。1 d后PcA形成了团聚和沉淀。吩噻嗪基团在硅(IV)酞菁的自组装形成均匀稳定的纳米粒子中起着关键作用。PcBF在水溶液中自组装形成均匀的纳米颗粒分布(NanoPcBF)。此外,NanoPcBF在水中和含10%胎牛血清的水中表现出较好的稳定性。与NanoPcAF相比,NanoPcBF在水中表现出类似的吸收,但更强的荧光强度。这些结果再次表明,吩噻嗪基团的引入有利于硅(IV)酞菁的自组装,形成稳定的纳米颗粒。在酞菁硅(IV)上引入两个吩噻嗪基团可能使NanoPcBF的内部分子排列不够紧密,因为PcBF的自组装行为可能只是由于疏水性和π−π堆积。然而,除了PcAF分子之间的疏水相互作用和π−π堆积外,PcAF酚羟基之间的氢键相互作用也可能促进PcAF的自组装行为。因此,NanoPcBF比NanoPcAF具有更强的荧光发射,不利于光动力和光热效应的改善。
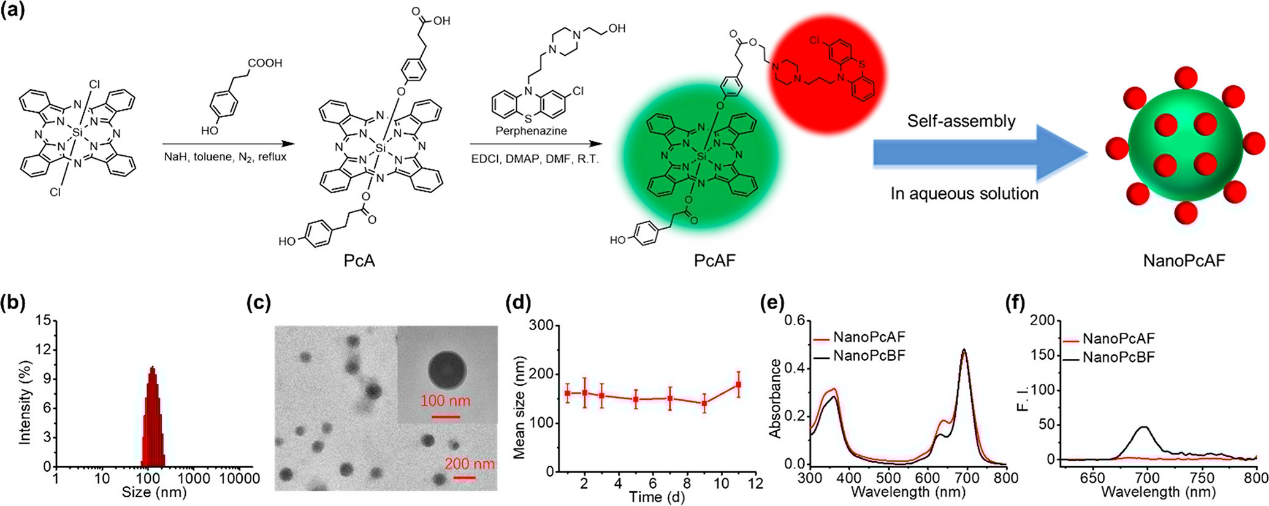
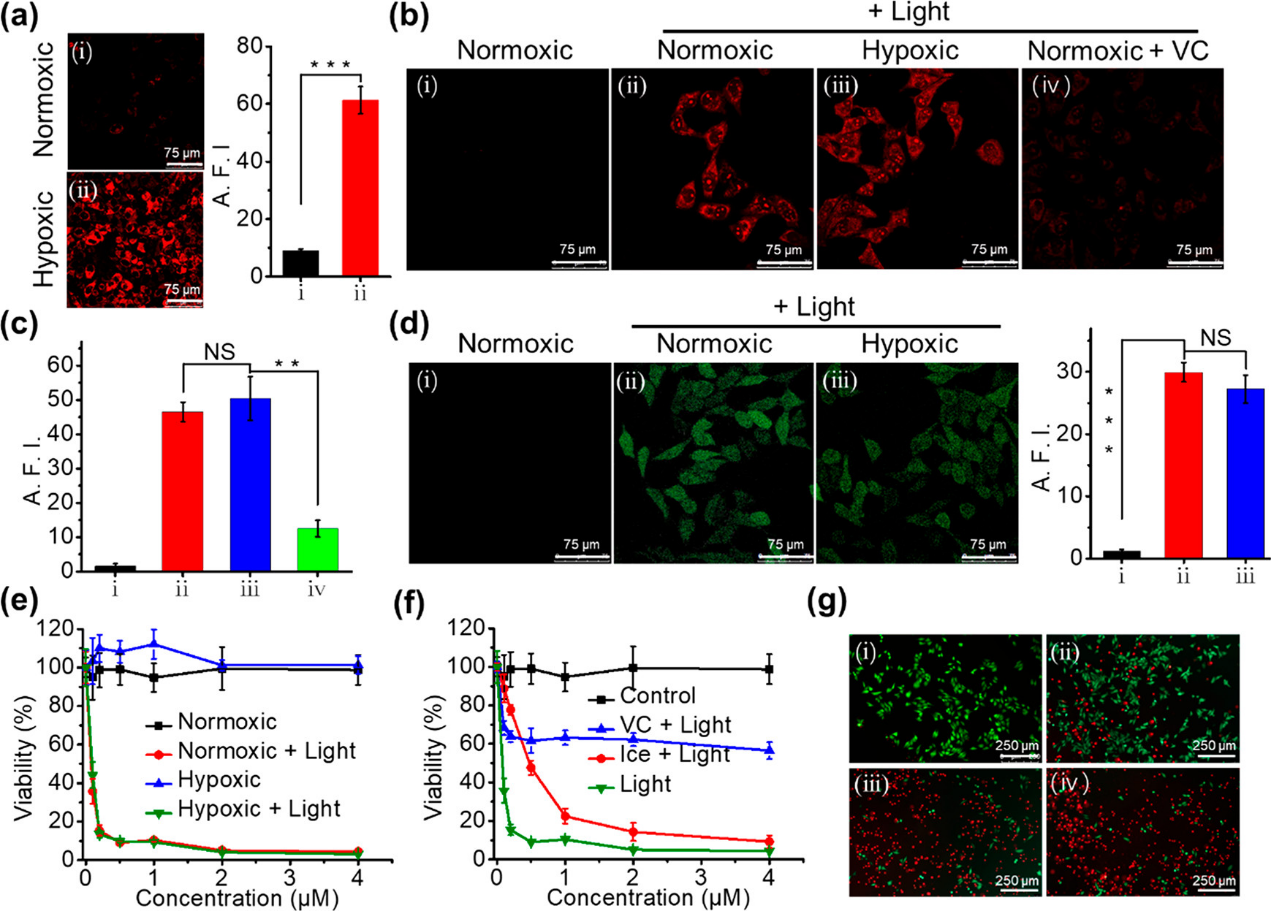
一般情况下,PS吸收的光子可以通过三种不同的方式释放,包括荧光、振动弛豫产生热量和进行系统间交叉(ISC),生成有利于ROS生成的三重态。NanoPcAF在水中的荧光较弱,表明NanoPcAF在光热治疗(PTT)和光动力治疗(PDT)中具有巨大的潜力。为了确认NanoPcAF的光动力学特性,在后续实验中测量了NanoPcAF的O2•−和1O2生成效率。二氢乙啶(DHE)作为荧光探针检测O2•−。NanoPcAF在光照射下生成O2•−的能力是NanoPcA的3.2倍。与MB相比,NanoPcAF也表现出更好的生成O2•−的能力。在低氧条件下,测量了NanoPcAF生成O2•−的能力。在NanoPcAF组中,DHE探针在缺氧条件下的荧光强度与正常条件下相比没有显著降低。这说明纳米NanoPcAF在光照射下生成O2•−与O2水平无关。在缺氧条件下,NanoPcAF产生的O2•−比MB多3.4倍。我们还探索了NanoPcBF生成O2•−的能力。与NanoPcAF相比,NanoPcBF表现出较弱的O2•−生成,这可能是因为NanoPcBF吸收的光能以荧光的形式释放更多。与NanoPcBF相比,NanoPcAF具有更高的低氧**PDT潜力。随后,采用单氧传感器绿色(SOSG)作为荧光探针检测1O2。MB在光照射下产生了显著的1O2。而NanoPcAF组中SOSG的荧光强度在光照射后几乎没有增加,说明NanoPcAF产生1O2的能力可以忽略不计。这些结果表明NanoPcAF具有良好的I型光反应,吩噻嗪基团在其中起着关键作用。
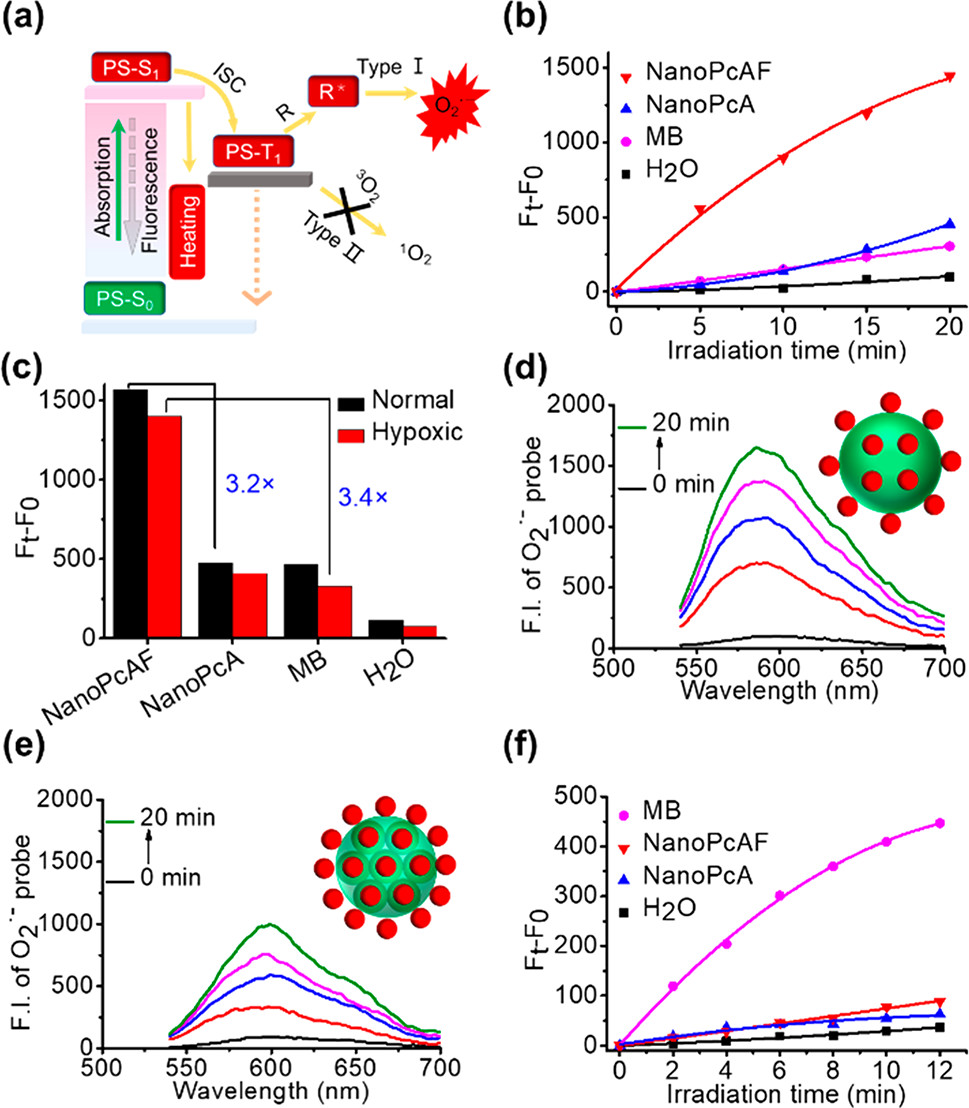
以水和ICG作为对照,研究了NanoPcAF的光热性能。NanoPcAF在水中的温度迅速升高,在光照射10 min后升高约30℃,而对照组的温度变化不明显。通过改变NanoPcAF的浓度和685 nm激光的能量密度来测量其在水中的光热效应。功率密度越大,温度升高越高。当激光功率密度保持在0.5 W cm−2时,还观察到显著的浓度依赖性温度升高。当NanoPcAF浓度为10 μM时,NanoPcAF在水中的温度达到57℃。NanoPcAF的光热转换效率达到18.3%,。此外,经过4次加热/冷却循环后,NanoPcAF没有观察到明显的光漂白。NanoPcAF的紫外-可见光谱在辐照10min后没有明显下降,而ICG在相同辐照时间内明显下降。这些结果表明NanoPcAF在PTT过程中保持了良好的光稳定性。NanoPcAF可以将传统硅(IV)酞菁的光物理和光化学性质从II型光反应转移到高效的I型光反应和振动松弛诱导光热转换。
首先评估了在常氧和缺氧条件下,NanoPcAF在人肝癌(HepG2)细胞内生成O2•−的能力。缺氧条件下厌氧指示器(ROS-ID)的荧光强度比正常条件下高6.9倍,说明后续体外实验成功构建了缺氧条件。随后,用DHE作为O2•−荧光指示剂检测NanoPcAF细胞内O2•−生成能力。在没有光照的情况下,NanoPcAF不能在细胞中产生O2•−。在685 nm光照射下,无论在常氧或低氧条件下,细胞都能观察到明显的DHE荧光。与常氧条件下相比,低氧条件下DHE荧光强度没有显示任何降低,表明NanoPcAF在常氧和低氧环境下均能诱导体外O2•−效率。此外,添加自由基清除剂维生素C (VC)后,细胞内O2•−降低了4.0倍,证实了NanoPcAF具有较强的生成O2•−的能力。我们还使用2,7-二氯荧光素二乙酸酯(DCFH-DA)作为探针,检测HepG2细胞中NanoPcAF细胞内ROS的生成。当细胞与NanoPcAF孵育而没有光照射时,不产生ROS。然而,在685 nm激光照射后,DCFHDA在常氧和缺氧条件下都显示出明亮的绿色荧光,说明无论在常氧或缺氧条件下,NanoPcAF都能有效地产生ROS。与常氧状态相比,低氧状态下细胞内ROS并没有降低,这与O2•−检测结果一致。采用3-(4,5-二甲基-2-噻唑基)-2,5 -二苯基- 2h -四唑溴化铵(MTT)比色法评价NanoPcAF的体外光治疗效果。NanoPcAF在黑暗环境下未观察到明显的毒性。而在685 nm光照,NanoPcAF在常氧和低氧条件下均表现出显著的浓度依赖性细胞毒性,90%的抑制浓度(IC90)分别为0.45±0.08 μM和0.42±0.10 μM。这些结果表明,O2浓度对NanoPcAF的细胞毒性没有影响。为了进一步证实NanoPcAF的体外光疗机制,一方面用VC处理细胞清除自由基。与NanoPcAF +光组相比,NanoPcAF + VC +光组的治疗效果明显下降,这应该是PDT受到抑制的结果。另一方面,冰袋被用来控制细胞的温度。与NanoPcAF +光组相比,NanoPcAF +冰+光组的细胞抑制作用也降低。NanoPcAF +冰+光组的IC50达到3.69±0.12 μM,是NanoPcAF +光组的8.2倍。这些结果表明PTT在光细胞毒性中也起重要作用。活/死细胞染色实验结果也表明PTT和PDT在NanoPcAF诱导细胞死亡的光细胞毒性中发挥了重要作用。NanoPcAF由于其优越的I型PDT和PTT能力,在常氧和缺氧条件下均具有较高的体外光治疗效果。这些结果进一步表明,NanoPcAF在光动力治疗中表现出高的I型光反应和光热作用协同效率来克服缺氧条件。
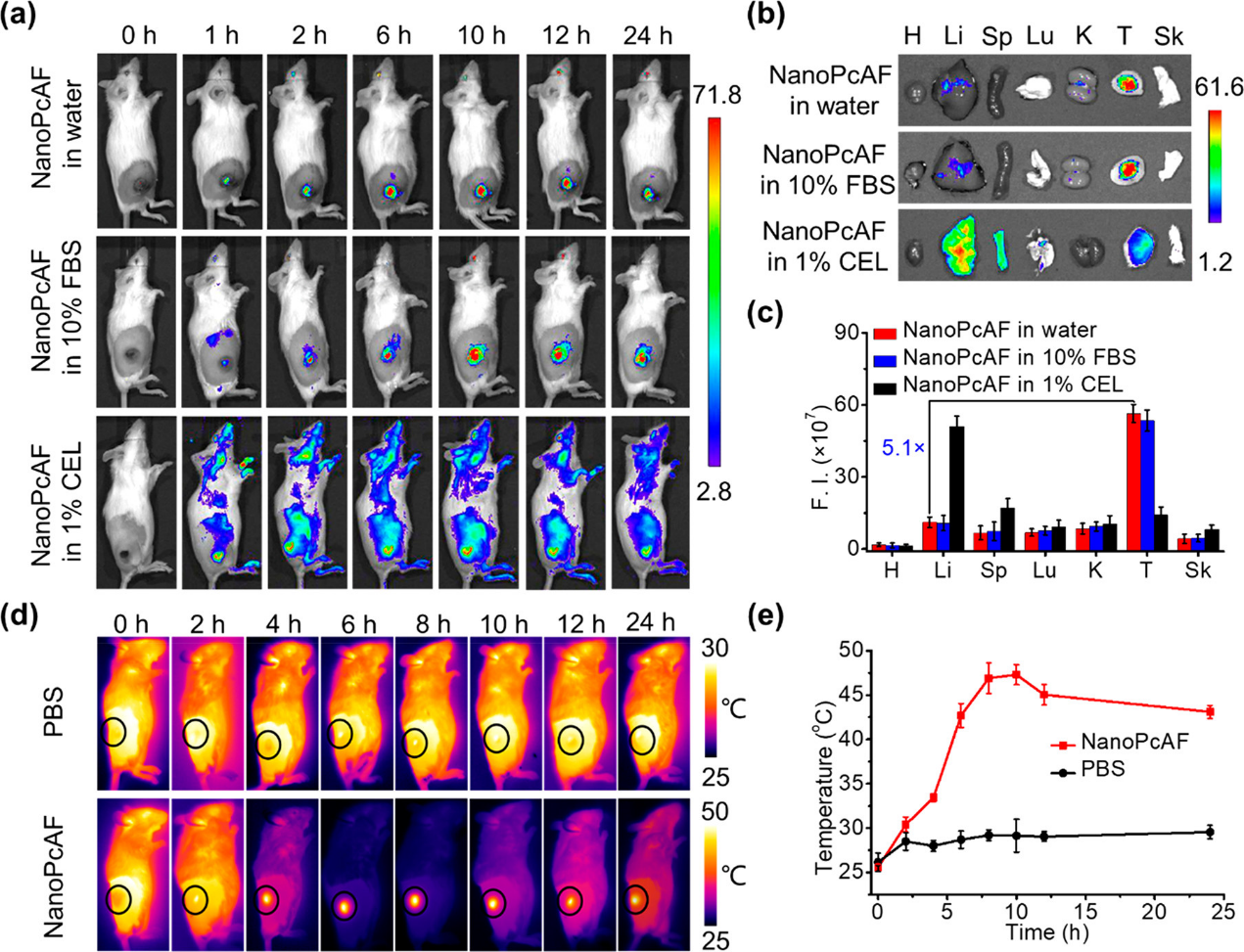
以肝癌(H22)小鼠为实验对象,静脉注射NanoPcAF,观察NanoPcAF的生物分布。选择H22是因为它相对容易建立**模型。利用荧光成像技术评价NanoPcAF在体内的生物分布。荧光图像连续监测至24 h,发现**部位的荧光信号逐渐增加,在10 h时达到最大值。虽然NanoPcAF在水中的荧光非常弱,荧光成像结果显示,注射NanoPcAF 10 h后,荧光信号清晰,且几乎只出现在**部位,这可能是由于NanoPcAF具有显著的**聚集能力,并在**部位恢复了荧光生成。老鼠牺牲24小时接受和**的荧光强度和其它主要器官包括皮肤、心、肝、脾、肺、肾进行评估。**部位的荧光信号远高于其他器官。**的荧光强度是肝脏的5.1倍。这个**/肝脏的比值比大多数报道的PSs要高得多,表明NanoPcAF具有出色的**靶向能力。为了研究NanoPcAF在体内的稳定性,还利用体内荧光成像技术评价了NanoPcAF在含10%胎牛血清的水中的生物分布。如图6a所示,荧光成像结果与在纯水中注射NanoPcAF的小鼠相似。此外,由于CEL是一种常见的表面活性剂,可以破坏PSs的自组装,因此在注射小鼠之前,我们使用cremoophor EL (CEL)破坏NanoPcAF的结构。在含1% CEL (v/v)的水中,PcAF在吸收光谱中呈现强烈吸收,在610 nm激发下发出强烈的荧光,说明NanoPcAF的纳米结构被CEL破坏。将含1% CEL的NanoPcAF注入荷瘤小鼠体内,荧光信号迅速扩散至全身,然后逐渐减弱,无明显**积聚。体外荧光分布也显示,荧光信号主要存在于肝脏。这些结果表明,NanoPcAF在生理环境中具有良好的稳定性,而未断裂的纳米结构在**选择性中发挥着关键作用。其次,利用光热成像监测NanoPcAF在体内的**积累。H22**小鼠静脉注射NanoPcAF。使用685 nm激光(0.5 W cm−2)每隔一小时照射**部位3分钟。在照射过程中,通过红外热像仪持续评估**部位的温度。热成像持续监测至24小时。注射NanoPcAF 10小时后,**部位温度明显升高,约升高28°C。光热成像观察到的**富集时间与上述荧光成像结果一致。
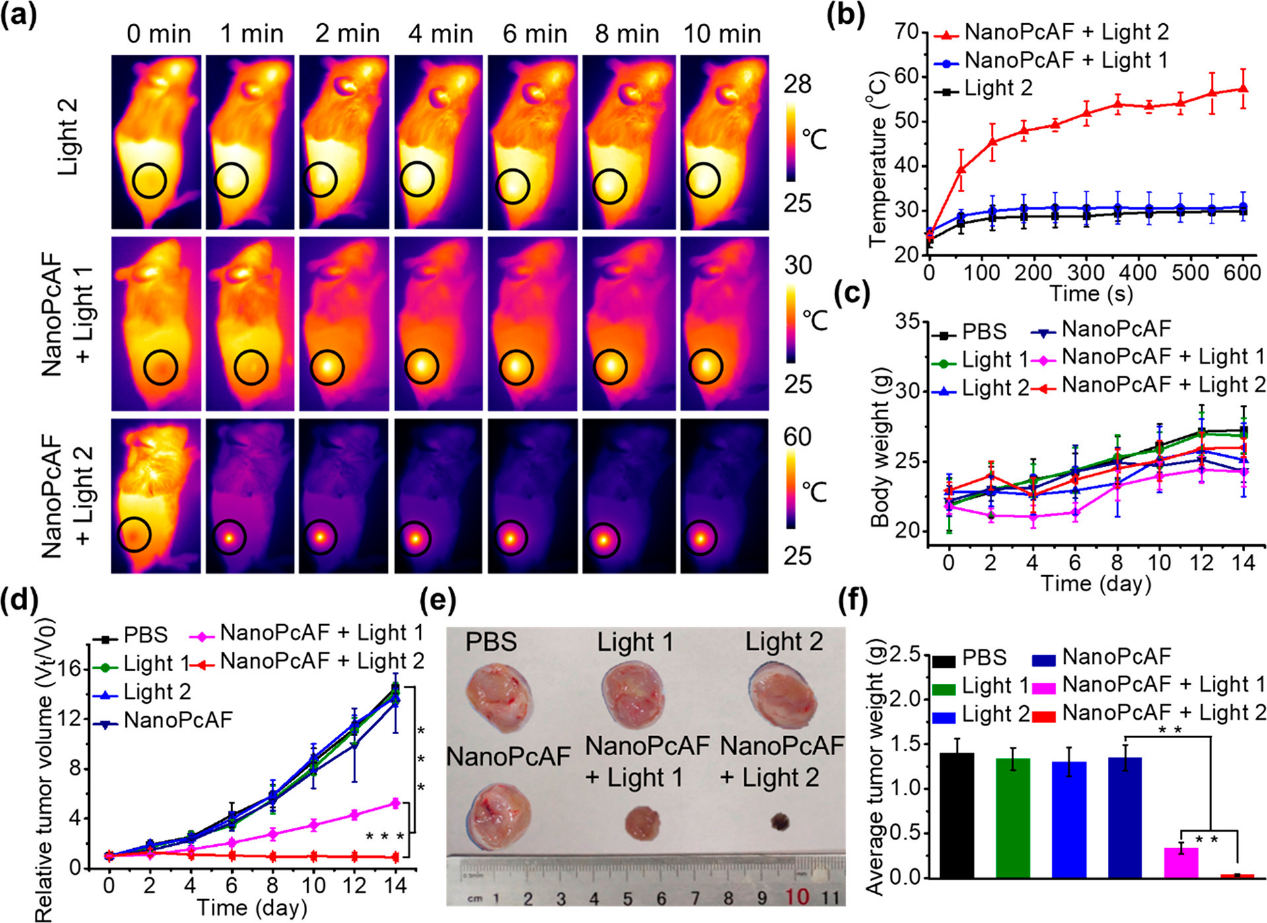
由于NanoPcAF具有良好的**聚集能力,我们进一步对H22荷瘤小鼠进行了体内光治疗。小鼠分为6组:(1)对待PBS(控制),(2)关照1(激光波长685 nm),(3)光照2(激光波长685 nm),(4) NanoPcAF,(5) NanoPcAF + light 1, 和(6) NanoPcAF + light 2,NanoPcAF联合光2照射小鼠后,温度升高约30°C。仅用光2处理的小鼠和先用NanoPcAF再用光1处理的小鼠的温度都有轻微变化。然后,每隔一天对各组小鼠的体重和**体积进行评估。各组小鼠体重无明显差异,并在治疗过程中保持稳定增长。小鼠**体积在不同组之间显示出显著的变化。所有对照组(包括PBS、light 1、light 2和NanoPcAF单独)均显示出显著水平的**生长,而NanoPcAF + light 1组和NanoPcAF + light 2组的**生长均受到明显抑制。14天之后,**治疗的老鼠1 NanoPcAF其次是光辐照表现出抑制增长64%,这应该来自PDT的影响是引起**部位的温度显示一个微不足道的增加后,老鼠接受NanoPcAF光1紧随其后。与NanoPcAF + light 1组相比,NanoPcAF + light 2组的**抑制效果显著提高(94%),这应该得益于PDT和PTT的联合作用。因此,这些结果表明,NanoPcAF通过PTT与I型PDT联合具有高效的抗**能力。代表性图像和**平均重量进一步证实了NanoPcAF在光照射下具有显著的抗**效果。
https://doi.org/10.1021/jacs.1c07479
| 序号 | 新闻标题 | 浏览次数 | 作者 | 发布时间 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 837 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 862 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基与NHS活性酯反应PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1639 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid叠氮八聚乙二醇羧酸 | 774 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 877 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮缩硫醇-聚磷酸酯 PPE-TK | 936 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙键响应性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 914 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在线咨询
在线咨询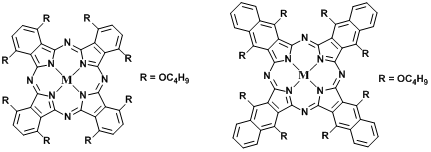








 库存查询
库存查询