- 029-86354885
- 18392009562
内容提要
CO不仅可以选择性地杀伤**细胞,而且由于缺乏主动的**靶向能力,抗**效果有限。将线粒体靶向的线粒体内微环境响应前药(FeCO-TPP)封装在介孔二氧化硅纳米颗粒内,再通过静电分步组装,将其包覆在透明质酸上,构建一种新型智能纳米药物,并以分步分解的方式实现**组织细胞/线粒体靶向的CO多阶段控制释放。CO的多阶段靶向控释释放包括(i)被动靶向**组织的纳米药物释放,(ii)主动靶向**细胞的纳米药物释放,(iii)酸响应性前药释放,(iv)线粒体靶向性前药释放以及(v)ROS响应性CO释放。该纳米药物有效地增强了CO在体内外治疗癌症的有效性和安全性。本文提出的多阶段组装/解组装策略为CO的靶向治疗打开了一个新的窗口。
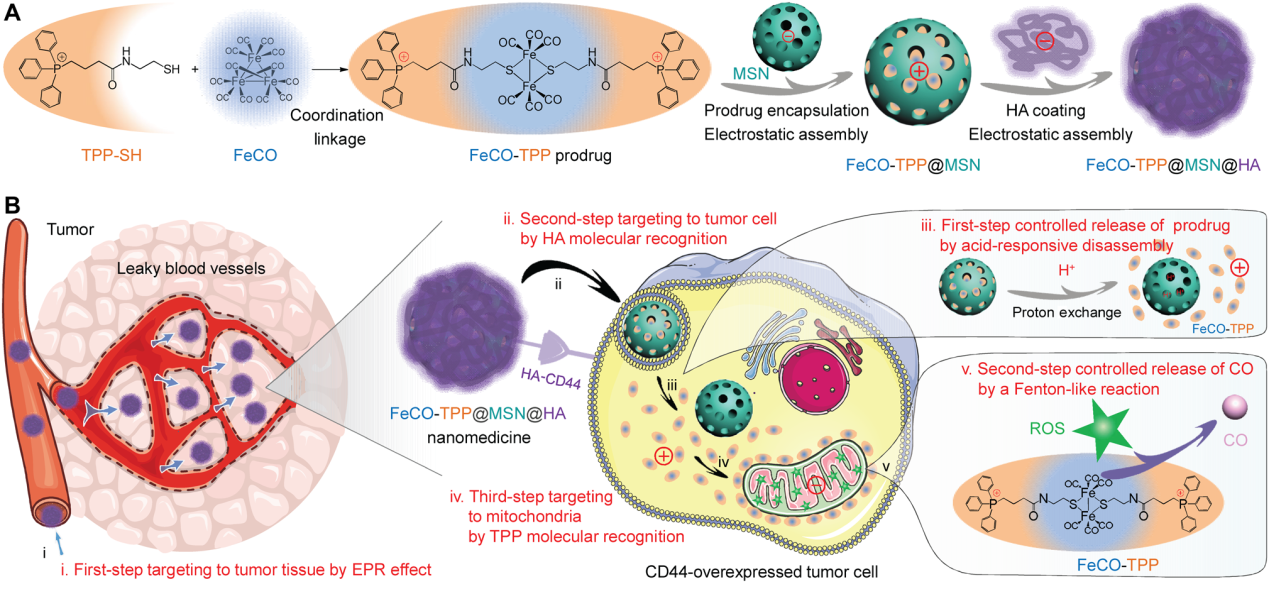
前言
高血药浓度和低瘤内积累分别会导致CO中毒风险和限制CO治疗疗效。目前CO治疗的两种主要给药途径是直接吸入CO气体和吸收CO前药。直接吸入CO气体很难控制CO的摄入量,而现有CO前药缺乏**靶向能力。两种CO给药途径都有较高的CO中毒风险。因此,CO的靶向释放和控释对于提高CO治疗的有效性和生物安全性至关重要。基于多功能纳米材料的智能纳米药物靶向递送CO前药和瘤内控释CO是一种重要策略。但是,已被开发的**靶向递送和控制释放CO的纳米药物只能将CO递送到溶酶体或细胞质中,而不是线粒体。线粒体是CO发挥其生理功能的靶点,其中CO通过与氧气激烈竞争结合细胞色素c氧化酶以损害**细胞线粒体生物能,从而抑制线粒体呼吸,导致**细胞凋亡。CO前药顺序靶向递送到**组织、细胞、线粒体可能会获得理想的CO治疗效果。作者提出了一种多阶段靶向释放和控释策略,构建了一种多功能智能纳米药物(FeCO-TPP@MSN@HA),有序实现纳米药物靶向**组织(第一步靶向)、靶向**细胞(第二步靶向)、一种新的CO前体药物的纳米药物酸响应释放(第一步控释),前体药物的线粒体靶向释放(第三步靶向),以及CO的线粒体内活性氧(ROS)响应释放(第二步控释)。本工作选择带负电荷的介孔二氧化硅纳米颗粒(MSN)作为生物相容性载体,通过静电组装有效地负载带正电荷的线粒体靶向/线粒体微环境响应药物前体FeCO-TPP前药,实现FeCO-TPP前药的酸响应降解和释放,通过静电组装将透明质酸(HA)进一步包覆在小型单分散二氧化硅(FeCO-TPP@MSN@ HA)表面,既可以通过增强通透性和保留(EPR)效应实现被动靶向**,也可以主动靶向过表达CD44的**细胞,通过分段靶向释放和控释,以逐步解组装的方式实现高效和安全的线粒体靶向CO治疗癌症的体内外,能够将CO递送到癌细胞的线粒体,显示出癌症治疗的最大结果。
结果与讨论
FeCO-TPP前药和FeCO-TPP@MSN@HA的关键是既能以靶向的方式积累到线粒体中,又能以响应的方式在线粒体中释放CO。带正电荷的TPP阳离子由于其静电和亲脂性吸引线粒体膜,是一种很好的线粒体靶向分子。此外,金属羰基化合物能够通过类Fenton反应,ROS响应分解为CO。作者将TPP衍生物[3-羧基丙基三苯基溴化膦(TPP-COOH)]与金属羰基化合物(FeCO)偶联,合成了前药FeCO-TPP。为了保护FeCO-TPP前药并将其运送到**细胞中进行后续线粒体靶向,作者利用带负电荷的MSN包覆带正电荷的FeCO-TPP,利用EPR效应进行**靶向传递,然后静电组装包覆一层HA (CD44的受体)来识别过表达CD44蛋白的**细胞。所合成的单分散二氧化硅具有均匀的粒径(约70 nm)、良好的分散性和高负的表面电位,有利于前药负载和HA包覆。从图1的D和E中可以发现,在单分散二氧化硅表面覆盖了一层较薄的低对比度HA (约15 nm)。SEM图像(图1F)和DLS数据(图1I)显示,合成的FeCO-TPP@MSN@HA纳米药物保持了良好的分散性,由于HA涂层,其水化直径略有增加(图1F和1I)。FeCO-TPP@MSN的高正电势使其易于静电组装,导致HA涂层使合成的FeCO-TPP@MSN@HA纳米药物的表面电位接近中性,并防止FeCO- TPP前药和HA涂层在水溶液中高稳定性的泄漏)。
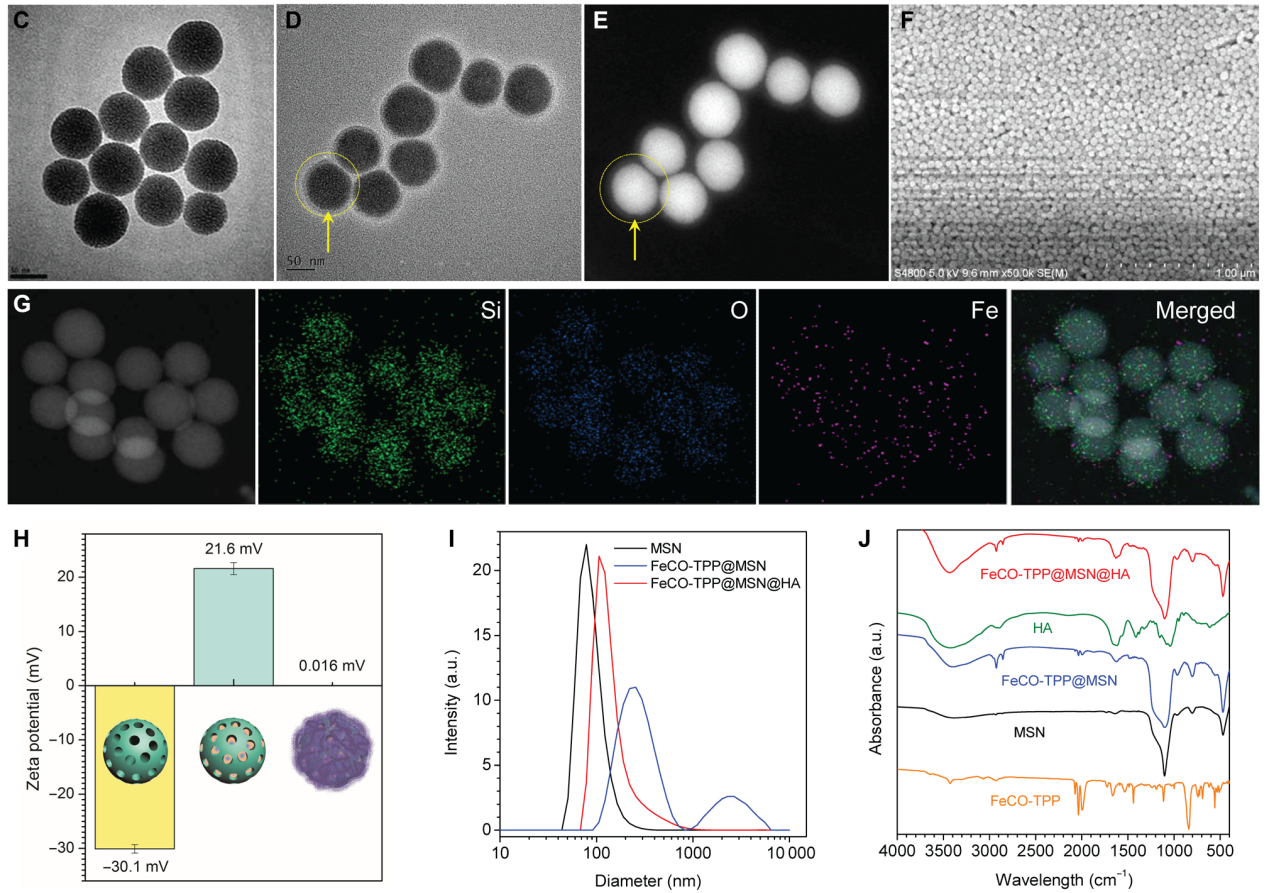
图1. (C) 单分散二氧化硅的透射电镜(TEM)图像。FeCO-TPP@MSN@HA的TEM (D),高角度环形暗场(HADDF) (E),扫描电子显微镜(SEM) (F)和元素映射(G)。MSN,FeCO-TPP@MSN和FeCO-TPP@MSN@HA的Zeta势(H),动态光散射(DLS)粒径分布(I)和FTIR光谱(J)。
FeCO-TPP@MSN@HA能够在到达**部位后识别/粘附到**细胞上,然后在被溶酶体吞入过程中脱去HA。为了证实这一顺序过程,包括靶向**组织的纳米药物递送,靶向**细胞的纳米药物递送,对酸敏感的前药释放,靶向线粒体的前药递送,首先在体外模拟条件下研究FeCO-TPP@MSN的酸/ ROS响应释放行为。FeCO-TPP@MSN在pH 7.4的PBS溶液中相当稳定,但在pH 6.8的微酸溶液中,FeCO-TPP前药的释放急剧,较高的酸度导致前药释放更快。这种酸响应行为来自于与带正电荷的FeCO-TPP前药物的质子交换(图2A)。MSN表面的许多硅醇基团(Si─OH)可以电离成硅酸盐(Si─O−)吸附FeCO-TPP+,也可以在酸性条件下质子化脱附/释放FeCO-TPP+。作者进一步研究了不同浓度·OH下释放的FeCO-TPP前药对ROS的响应性CO释放行为以模拟线粒体富集ROS的微环境。在·OH存在的情况下,FeCO-TPP由于·OH的强烈氧化而分解为CO(图2B)。根据**的Warburg效应,·OH浓度越高,CO释放越快,对恶性**细胞的影响越强烈。
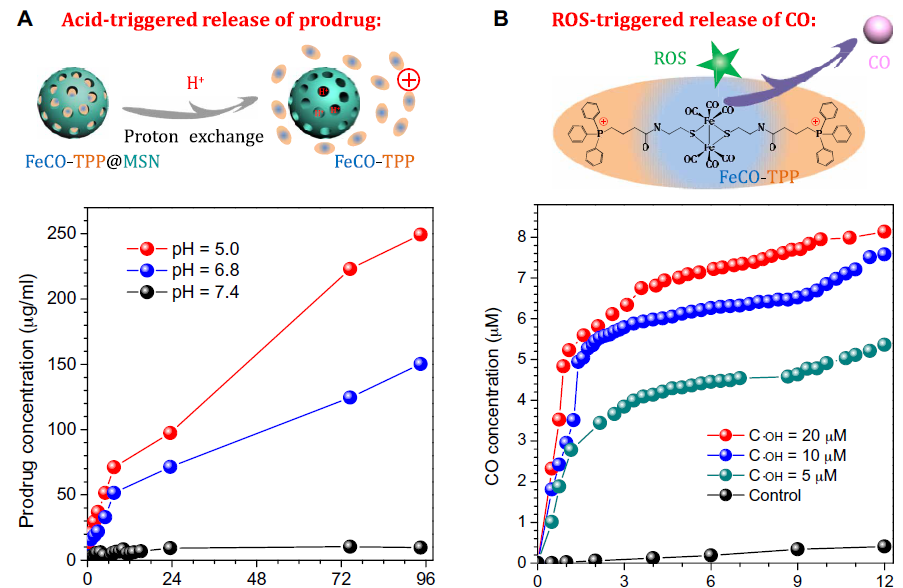
图2. FeCO-TPP@MSN纳米药物在体外模拟条件下的酸响应性前药释放曲线(A)和FeCO-TPP前药在不同·OH浓度下的线粒体内ROS响应性CO释放曲线(B)。
利用激光共聚焦对体外连续多阶段靶向释放和细胞控释过程进行了评价。首先,分别用红罗丹明B异硫氰酸酯(RITC)和8-巯基喹啉(QL)标记MSN载体和FeCO-TPP前药构建FeCO-TPP@MSN@HA纳米药物进行荧光示踪。HeLa和4T1细胞在相同条件下与其他癌细胞相比,可以更有效地吞入FeCO-TPP@MSN@HA纳米药物,因为它们的CD44显著过表达(图3A)。同时,纳米药物很少被正常的MCF-10A和人类胚胎肾(HEK) 293T内吞,因为CD44正常低表达的细胞,因此该纳米药物可以专一靶向CD44过表达的癌细胞,并进行靶向给药。作者选择具有最高识别性的HeLa细胞进行进一步靶向释放和控释阶段的研究。HeLa细胞内吞FeCO-TPP@MSN@HA后,主要位于溶酶体(图3B),主要体现在绿色和红色合并成黄色。蓝色逐渐出现,表明FeCO-TPP前药从纳米药物在溶酶体的酸性环境中的持续释放。为了追踪前药在线粒体内的靶向性,我们在与纳米药物共孵卵后,用绿色MitoTracker染料对HeLa细胞线粒体进行染色。将MSN载体和FeCO-TPP前药分别用红色RITC和蓝色QL标记,构建FeCO-TPP@MSN@HA纳米药物进行荧光示踪。为了便于区分药物释放监测的颜色,我们将共焦图像中的线粒体和MSN通道分别设置为红色和绿色。红色和蓝色的出现产生了紫色,代表前药在线粒体内的积累。紫色的增加代表线粒体,对释放的FeCO-TPP前药的摄取(图3C)。随着前药在溶酶体中从纳米药物释放,前药通过TPP分子识别逐渐积累到线粒体中,表现为线粒体靶向前药传递阶段。FeCO-TPP前药的线粒体靶向能力归功于其与线粒体膜的静电和亲脂性吸引,为线粒体响应性CO释放提供了机会。荧光COP-1 (CO probe -1)探针用于检测细胞内CO释放。随着孵育时间的增加,绿色荧光强度的增强反映了CO在HeLa细胞中释放的增加(图3D)当FeCO-TPP前药到达HeLa细胞线粒体时,线粒体内ROS触发了CO的释放,这是由于其ROS响应行为。以上四个方面的研究结果证实了多阶段顺序靶向释放和控释过程。
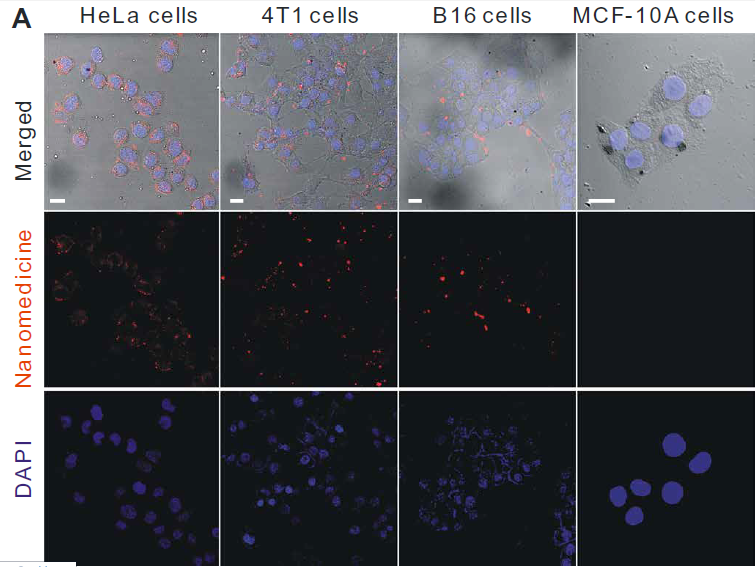
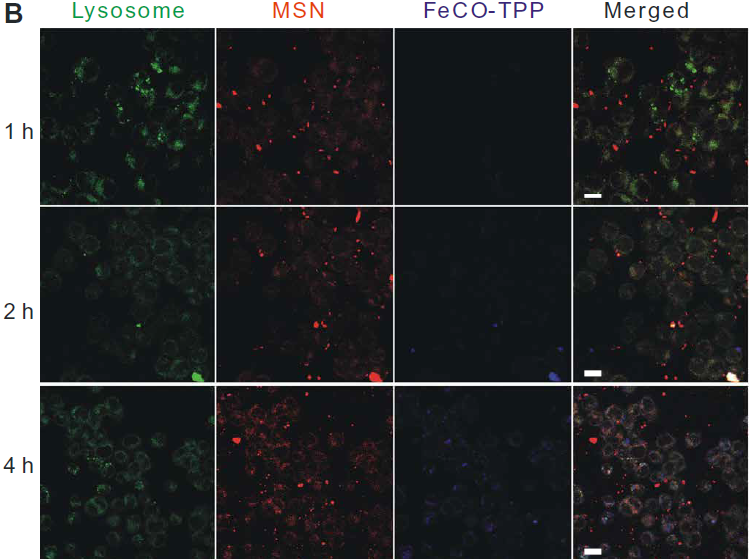
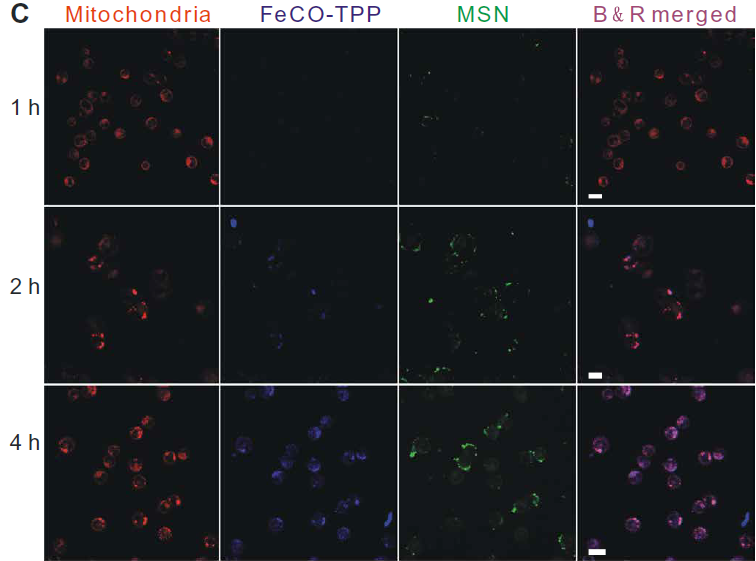
图3所示。 (A) HeLa、4T1、B16和MCF-10A细胞与FeCO-TPP@MSN-RITC@HA孵育4小时,并用4,6-二氨基-2-苯吲哚(DAPI)染色,MSN载体用红色的RITC标记,然后用于构建FeCO-TPP@MSNRITC@HA纳米药物。(B) FeCO-TPP@MSN@HA纳米药物的溶酶体内酸响应前药释放行为,LysoTracker染色(绿色),FeCO-TPP前药用蓝色QL(8-巯基喹啉)标记。(C) FeCO-TPP@MSN@HA纳米药物的线粒体靶向前药物传递行为,MitoTracker(红色)染色。
选择两个**细胞系(HeLa和4T1)和两个正常细胞系(HEK-293T和MCF-10A)研究FeCO-TPP@MSN@HA纳米药物的体外抗癌性能。从图4 (A到D), FeCO-TPP,FeCO-TPP@MSN和FeCO-TPP@MSN@HA对两种癌细胞均表现出剂量和时间依赖性的细胞毒性行为,但在0-100 mg/ml浓度范围内,尽管孵育时间较长,对正常细胞的毒性不显著。与FeCO-TPP和FeCO-TPP@MSN相比,FeCO-TPP@MSN@HA纳米药物在相同的孵育浓度和时间下对癌细胞的损伤最大,这可能与靶向给药有关。从图4 (A和B), FeCO-TPP@MSN@HA对HeLa和4T1细胞的ED50分别为82.6和41.5 mg/ml)。作者还使用CORM-3作为CO供体来测量ED50值在HeLa和4T1细胞上CO的浓度分别为147.3和110.9 mM。尽管CO持续释放,FeCO- TPP@MSN@HA仍容易快速达到足够高的CO浓度杀灭**细胞。FeCO- TPP@MSN@HA的细胞毒性随着孵育时间的延长而显著增加(图4,A和B),甚至高于游离前药FeCO- TPP。这可能是由于HA介导的靶向抑制正常细胞对FeCO- TPP@MSN@HA纳米药物的摄取和/或CO的保护作用。作者还从细胞能量代谢的角度研究了纳米药物的癌症选择性机制。从图4 (E H), MSN几乎没有影响腺苷5 '三磷酸腺苷(ATP)含量的HeLa和MCF-10A细胞,而FeCO-TPP FeCO-TPP@MSN,和FeCO-TPP@MSN@HA显著抑制ATP的HeLa细胞水平按照线粒体数量减少(图4,I和J),导致抗癌的结果。此外,细胞内乳酸水平FeCO-TPP@MSN@HA治疗后明显增强,表明在糖酵解过程中有氧呼吸的HeLa细胞被CO抑制,而无氧呼吸和乳酸消耗被激活,导致HeLa细胞ATP水平下降。虽然FeCO-TPP和FeCO-TPP@MSN也抑制了MCF-10A细胞的ATP水平(图4E),但线粒体数量并没有减少(图4,K和L),这可能是因为从其泄漏的带正电荷的FeCO-TPP和FeCO-TPP@MSN和/或CO容易被内吞噬,从而在一定程度上影响线粒体功能,而中性的FeCO-TPP@MSN@HA不泄漏CO则不会。FeCO-TPP@MSN@HA对MCF-10A细胞的ATP水平和线粒体数量均无影响(图4,E, K和L),因为它具有识别CD44的能力,反映了对正常细胞的低细胞毒性。基础呼吸情况与ATP产生情况相似(图4F),但经FeCO-TPP@MSN和FeCO-TPP@MSN @HA处理的MCF-10A细胞的最大呼吸和质子泄漏仍保持不变(图4G),进一步说明了保护作用。综上,FeCO-TPP@MSN@HA纳米药物损害了癌细胞线粒体功能,但保护了正常细胞的线粒体,维持正常的能量代谢。
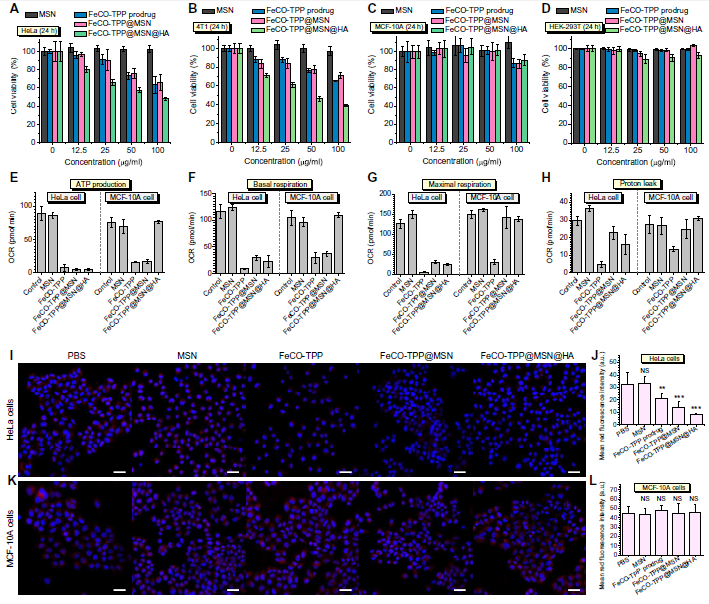
图4. (A到D) FeCO-TPP@MSN@HA纳米药物对癌症(HeLa和4T1细胞)和正常(MCF-10A和HEK-293T细胞)模型细胞系的细胞毒性。(E to H)通过ATP产生(E)、基础呼吸(F)、最大呼吸(G)和质子泄漏(H)评价细胞能量代谢。(I和K)处理后的HeLa和MCF-10A细胞共聚焦图像,细胞核和线粒体分别染成蓝色和红色。(J)和(L)分别为(I)和(K)中红色荧光强度的定量。平均值和误差用平均值±SD表示。P值采用双尾Student 's t检验计算(**P < 0.01, ***P < 0.001;NS,差异无统计学意义)。比例尺(I和K), 20 mm。OCR,耗氧量
在静脉注射FeCO-TPP@MSN@HA纳米药物用于**治疗之前,首先静脉注射FeCO-TPP@MSN@HA后检查其血液安全性与PBS对照、MSN载体、FeCO-TPP前药和FeCO-TPP@MSN进行比较,其中包含等量的MSN和FeCO-TPP。采集不同时间点(注射后1、7、20天)的血样进行测定。与PBS对照相比,相同剂量的MSN载体、FeCO-TPP前药和FeCO-TPP@MSN, FeCO-TPP@MSN@HA在注射后20天内(治疗时间相同)未对肝脏和肾功能造成重大损害。此外,白细胞、红细胞、血红蛋白、红细胞压积、平均红细胞体积、平均红细胞血红蛋白、平均红细胞血红蛋白浓度、红细胞体积分布宽度等标准血液学指标水平无明显差异,表明FeCO-TPP@MSN@HA具有较高的血液相容性。使用FeCO-TPP@MSN@HA纳米药物进行体内治疗,分别使用携带B16和4T1**的小鼠模型。首先,研究了**靶向传递行为。从Fig. 5A的体内荧光成像结果可以发现,游离的FeCO-TPP快速排出,瘤内积累很少,而MSN和FeCO- TPP@MSN@HA均能有效积累到**中。从CD31染色(绿色血管)的**切片显示,FeCO- TPP@MSN@HA纳米药物溢出(图5B),并与封装的FeCO- tpp前药一起渗透到**细胞中(图5C),表明所研究的**的EPR效应和纳米药物对**的有效靶向传递。B16荷瘤**小鼠随机分为5组(n = 5)静脉注射PBS控制, MSN载体), FeCO-TPP前体药物, FeCO-TPP@MSN和FeCO-TPP@MSN@HA,分别等摩尔浓度的MSN或FeCO-TPP。从图5 (D - F)的治疗结果来看,MSN载体对B16荷瘤小鼠的**生长没有影响。相比之下,FeCO-TPP在治疗20天后虽无**靶向能力,但对**生长有轻微抑制作用,而FeCO-TPP@MSN由于其被动作用,在一定程度上增强了**治疗效果目标的行为。此外,FeCO-TPP@MSN@HA可以进一步提高**治疗疗效由于其被动和主动目标概要文件(图5 D, F)。的H&E染色**切片进一步证实FeCO-TPP@MSN@HA纳米药物可以消除**细胞最有效而FeCO-TPP和FeCO-TPP@MSN(图5 g)。各治疗组对心、肝、脾、肺、肾等主要脏器均未造成明显损伤,说明治疗剂量时生物相容性良好。用FeCO-TPP@MSN@HA纳米药物治疗的小鼠没有明显的体重减轻,这表明健康状况良好。
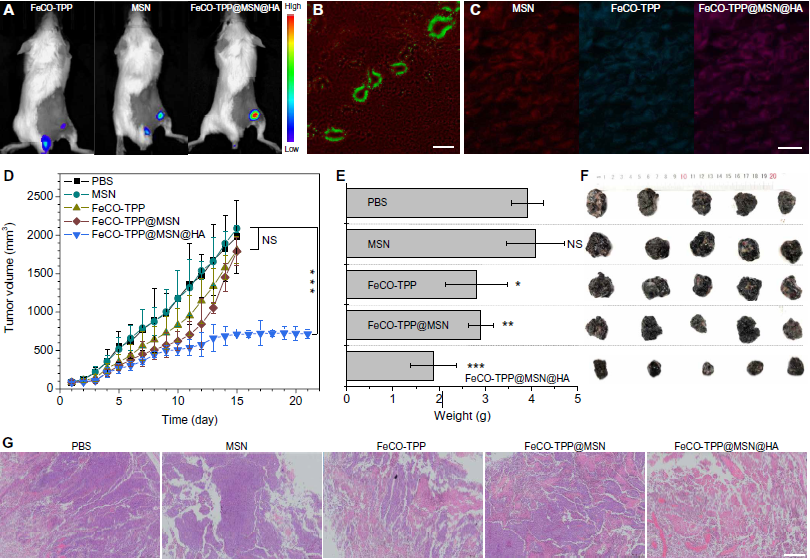
图5. **靶向的荧光图像:FeCO-TPP**小鼠静脉注射的药物前体,MSN的载体,FeCO-TPP@MSN@HA(A)。FeCO-TPP@MSN@HA治疗的**切片CD31染色(B和C),绿色,红色,和蓝色代表血管,MSN,和FeCO-TPP。纳米药物治疗B16**的结果:**体积随时间变化(D),治疗20天后**重量比较(E),小鼠体重随时间变化(F), H&E染色对治疗后**的组织学分析(G)。平均值和误差用平均值±SD表示。通过Tukey事后检验的单因素方差分析(ANOVA)计算P值,以校正多重比较(*P < 0.05, **P < 0.005, ***P < 0.0005)。比例尺200mm
序号
新闻标题
浏览次数
作者
发布时间
1
瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine
837
瑞禧生物
2022-11-09
2
科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne
862
瑞禧生物
2022-11-09
3
胺基与NHS活性酯反应PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物
1639
瑞禧生物
2023-01-03
4
瑞禧2023更新 Azido-PEG8-acid叠氮八聚乙二醇羧酸
774
瑞禧生物
2023-01-03
5
嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL
877
瑞禧生物
2022-12-08
6
活性氧敏感聚合物TK-PPE 酮缩硫醇-聚磷酸酯 PPE-TK
936
瑞禧生物
2022-12-08
7
功能化腙键响应性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽
913
瑞禧生物
2022-12-08


 400-115-0588
400-115-0588 在线咨询
在线咨询







 库存查询
库存查询